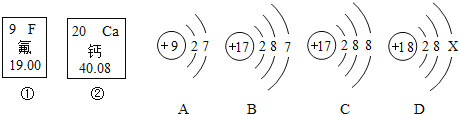
题目内容
【题目】分析下列实验回答下列问题:
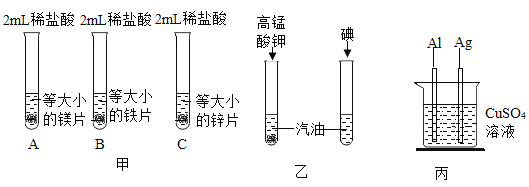
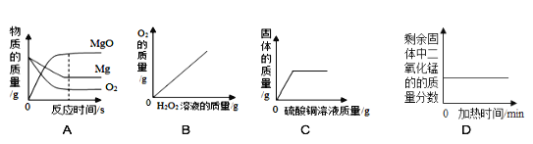
(1)甲为验证Mg、Zn、Fe金属活动性顺序的实验,通过比较_____可以得出的结论,写出反应前后溶液颜色发生变化的一组反应的化学方程式:_____。
(2)乙实验的目的是_____。
(3)写出丙实验中发生反应的化学方程式:_____。
【答案】三种金属与盐酸反应的速率或剧烈程度 Fe+2HCl═FeCl2+H2↑ 比较不同溶质在同种溶剂中的溶解性 2Al+3CuSO4═Al2(SO4)3+3Cu
【解析】
(1)在金属活动性顺序中,氢前的金属能与酸反应生成氢气,位置越靠前,反应的速度越快,三种金属与盐酸反应的速率或剧烈程度可以得出的结论;铁与盐酸反应生成氯化亚铁溶液和氢气,氯化亚铁溶液为浅绿色,化学方程式为:Fe+2HCl═FeCl2+H2↑.故填:三种金属与盐酸反应的速率或剧烈程度;Fe+2HCl═FeCl2+H2↑。
(2)乙实验形成对照,变量为溶质的种类,目的是比较不同溶质在同种溶剂中的溶解性;故填:比较不同溶质在同种溶剂中的溶解性;
(3)丙实验中铝与硫酸铜反应生成硫酸铝和铜,发生反应的化学方程式为:2Al+3CuSO4═Al2(SO4)3+3Cu.故填:2Al+3CuSO4═Al2(SO4)3+3Cu。

 一本好题口算题卡系列答案
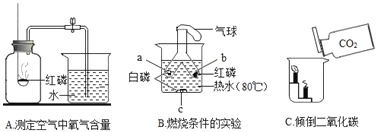
一本好题口算题卡系列答案【题目】氧气是一种化学性质比较活泼的气体,它能与许多物质发生反应.
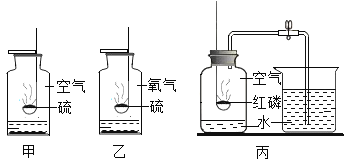
(1)图乙实验中,硫在氧气中燃烧的现象为_____,反应的化学方程式为_____,反应类型为_____.相同条件下,图甲、乙实验现象较为剧烈的是_____,原因可能是_____.
(2)图丙是测定空气中氧气含量实验,其中发生反应的化学方程式为_____,几组实验测定数据如下表(集气瓶的容积为100mL).
组别 | 1 | 2 | 3 | 4 | 5 |
进入集气瓶中水的体积/mL | 21 | 19 | 22 | 15 | 20 |
分析实验数据,第1,2,3,5组验证出氧气约占空气体积的_____,第4组出现较大偏差的原因可能是_____.不能用硫代替红磷测定空气中氧气含量的原因是_____.