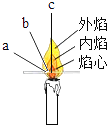
��Ŀ����
����Ŀ��ij��ѧ��ȤС�������������������ǡ������Ӽ���һ��������ˮ���壬��һ���DZ�עΪ���εİ�ɫ��ĩ������������������ְ�ɫ��ĩ����ˮ����Ϻ������ʹ����ʯ��ˮ����ǵ����塣Ϊȷ����ɫ��ĩ�Ļ�ѧ�ɷֽ���������̽����
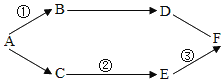
��������룩����1��̼���ƣ�����2��̼�����ƣ�����3��̼���ƺ�̼������
���������ϣ���̼������Һ��̼��������Һ���ʼ��ԣ�
��̼���������ȷֽ�����̼���ƣ�ˮ�Ͷ�����̼��̼�������Ȳ��ֽ⡣
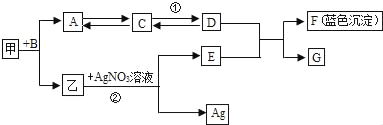
��ʵ��̽����С����С�շֱ���йز�����Ʒ���������ʵ�飺
ʵ����� | ʵ������ | ʵ����� | |
С�� | ����ɫ��ĩ����ˮ��pH��ֽ�ⶨ�����ȡ� | pH__________�����������������7�� | ��Һ�ʼ��ԣ�����1������ |
С�� | ����ͼ��ʾ��װ�ý���ʵ�顣 | �Թ�A����ˮ��������Թ�B��Һ�����ǡ� | ����2�������Թ�B�з�Ӧ�Ļ�ѧ����ʽΪ__________�� |
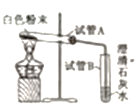
��ʵ�����ɣ�
��1��С����ΪС����ʵ����۲���ȷ��������__________����������������
��2��С����ΪС�յ�ʵ�鲢���ܵó�����2������������__________����������������
��ʵ��̽��2��
Ϊ�˽�һ��ȷ����ɫ��ĩ�Ļ�ѧ�ɷ֣�С����ȡ10g��ɫ��ĩ������ϡ���ᷴӦ����ַ�Ӧ�����ɶ�����̼����Ϊmg��ͨ�����㲢����ʵ������ȷ������3��������m��ȡֵ��ΧΪ__________���������÷�����ʾ����
�����۷�����
̽�������Dz鵽�ð�ɫ��ĩ�ijɷ�Ϊ̼�����ơ���ô����Ϊ��ɫ��ĩ�е�̼��������β����ģ�д������̼���ƵĻ�ѧ����ʽ__________��
���𰸡���Ca(OH)2+CO2=CaCO3��+H2O̼��������ҺҲ�ʼ��Ի�̼���ơ�̼��������Һ���ʼ��ԡ���������дһ�������֣������ų���ɫ��ĩ�к���̼���ƻ���֪����ɫ��ĩ���Ƿ���̼���ƻ��ɫ��ĩ�п��ܺ���̼���ƻ��ɫ��ĩ��̼���ƺ�̼�����ƵĻ����ʱ������Ҳ���������ʵ������������дһ�������֣�![]() ��
��![]() 2NaHCO3
2NaHCO3![]() Na2CO3+H2O+CO2��
Na2CO3+H2O+CO2��
��������
ʵ��̽����
��1��������ҺpHֵ����7�������
��2��̼���������ȷֽ�����̼���ƣ�ˮ�Ͷ�����̼���Թ�B��Һ����������Ϊ���ɵĶ�����̼������������Һ��Ӧ���ɰ�ɫ����̼��ƺ�ˮ����ѧ����ʽΪCa(OH)2+CO2=CaCO3��+H2O
ʵ�����ɣ�
��1��̼������Һ��̼��������Һ���ʼ��ԣ�����ͨ����Һ���Ƚ��м���
��2��С�յ�ʵ��ֻ��˵����ĩ�к���̼�����ƣ�������֤̼�����Ƿ���ڡ������ĩҲ�п���Ϊ̼���ƺ�̼�����ƵĻ���
ʵ��̽��2��
��1������10g����ȫ��Ϊ̼���ƣ���Ӧ��ѧ����ʽΪNa2CO3+2HCl��2NaCl+H2O+CO2���������ɶ�����̼������Ϊ![]() g������10g����ȫ��Ϊ̼�����ƣ���Ӧ��ѧ����ʽΪNaHCO3+HCl��NaCl+H2O+CO2��,�����ɶ�����̼������Ϊ
g������10g����ȫ��Ϊ̼�����ƣ���Ӧ��ѧ����ʽΪNaHCO3+HCl��NaCl+H2O+CO2��,�����ɶ�����̼������Ϊ![]() g����������3�����������ɵĶ�����̼��������������֮�䣬m�ķ�ΧΪ
g����������3�����������ɵĶ�����̼��������������֮�䣬m�ķ�ΧΪ![]() �������
�������![]() ��
��
����
̼���������ȷֽ�����̼���ƣ�ˮ�Ͷ�����̼����̼�����Ƿֽ������ģ���ѧ����ʽΪ2NaHCO3![]() Na2CO3+H2O+CO2����
Na2CO3+H2O+CO2����

����Ŀ���µ�һ�꣬ͬѧ�ǵ�ѧϰ��ʽ���˺ܴ�仯�������ǡ�������ȡ���ռ���ѧϰ�Ŀ���Ƭ�Σ�
������ѧϰ������������ȡ��ѧϰ��������ȡ��һ��˼·���Ķ��α�����ʦ�ṩ�˼���ҩƷ����ͬѧ�ǽ�����ѡ������ʵ������ȡ������̼��һ�顣
������������Χ���������⣬��С��չ���˼��ҵĽ�������������ʦ�ӵڶ�С��ͬѧ�����������ĸ�λѧ���ķ��ԣ�
1�ţ�̼�����ÿ�״ʯ��ʯ����Ҫ�ɷ�̼��ƣ���Ϊʲô���ô��̼���ƣ��أ�
3�ţ�̼�����Ƿ�δ״�ģ���Ӧ���ٶ�̫�죬�����ƣ�
2�ţ�ͬ��3��ͬѧ��˵���������ǰ�̼����ѹ�Ƴɿ�״������
��λ����˼��������δ�ܽ����
��չʾ���ɡ�ͨ������С���չʾ�����������ʵ������ȡ������̼Ӧ��ѡ��ʯ��ʯ��ϡ���ᡣ
ʵ��ʵ���У����õ�ԭ�ϻ����һ�㶼�������ʣ��ڼ������ϺͲ���ʱ��Ӧ���ǵ��������⡣
�����������ѧ�����2��ѧ����������⣬ʵ���Ұ�̼����ѹ�Ƴɿ�״_______(ѡ����ԡ������ԡ�)����ʯ��ʯ��ȡ������̼��
������������ijС����ⶨ����ʯ��ʯ��Ʒ��̼��Ƶ�����������ȡ����2g��ʯ��ʯ��Ʒ����20gϡ���ᣨ�Ȼ����ˮ��Һ����4�μ�����Ʒ�У�����Ʒ�г�̼����⣬����ɷּȲ������ᷴӦ��Ҳ���ܽ���ˮ������ַ�Ӧ���ˡ�����Ȳ���������������ʵ���������£�
ϡ��������� | ʣ���������� |
��һ�μ���5g | 1.5g |
�ڶ��μ���5g | 1.0g |
�������5g | 0.5g |
���Ĵμ���5g | 0.3g |
��1�����������ݿ�֪�����Ĵ�ʵ���У���______��ʯ��ʯ��Ʒ��̼�������ȫ��Ӧ��
��2����ʯ��ʯ��̼��Ƶ�����������
��3�����������������������̼��������