题目内容
【题目】氧化钙和过氧化钙(CaO2)的混合物12.8g溶于足量水后,加入足量的Na2CO3溶液,溶液中的Ca2+全部转化为沉淀,过滤、干燥,得到20g CaCO3。则原12.8g混合物中钙元素与氧元素的质量之比为(已知2CaO2+2H2O===2Ca(OH)2+O2↑)( )
A. 5:2 B. 5:3 C. 5:4 D. 1:1
【答案】B
【解析】
根据钙元素守恒可得钙元素与碳酸钙之间的关系式或者用化学式求算钙元素质量,进而推出混合物中氧元素的质量,求算质量比。
解:设钙元素的质量为x,根据CaO+H2O=Ca(OH)2、2CaO2+2H2O=2Ca(OH)2+O2↑、Ca(OH)2+Na2CO3=CaCO3↓+2NaOH;可得关系式为:
Ca------CaCO3
40 100
x 20g
![]()
x=8g,
原12.8g混合物中钙元素与氧元素的质量之比为8g:(12.8g-8g)=5:3。故选B。

【题目】某化学兴趣小组获得两包制作“跳跳糖”的添加剂。一包是柠檬水晶体,另一包是标注为钠盐的白色粉末。将少量柠檬酸和这种白色粉末溶于水,混合后产生了使澄清石灰水变浑浊的气体。为确定白色粉末的化学成分进行了以下探究:
(提出猜想)猜想1:碳酸钠;猜想2:碳酸氢钠;猜想3:碳酸钠和碳酸氢钠
(查阅资料)①碳酸钠溶液,碳酸氢钠溶液均呈碱性;
②碳酸氢钠受热分解生成碳酸钠,水和二氧化碳;碳酸钠受热不分解。
(实验探究)小亮,小刚分别对有关猜想设计方案并进行实验:
实验操作 | 实验现象 | 实验结论 | |
小亮 | 将白色粉末溶于水后pH试纸测定其酸碱度。 | pH__________(填“>”或“<”或“=”)7。 | 溶液呈碱性,猜想1成立。 |
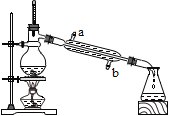
小刚 | 用右图所示的装置进行实验。 | 试管A中有水珠产生,试管B中液体变浑浊。 | 猜想2成立,试管B中反应的化学方程式为__________。 |
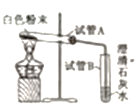
(实验质疑)
(1)小红认为小亮的实验结论不正确,理由是__________。(用文字叙述)
(2)小明认为小刚的实验并不能得出猜想2成立,理由是__________。(用文字叙述)
(实验探究2)
为了进一步确定白色粉末的化学成分,小威称取10g白色粉末与足量稀盐酸反应,充分反应后生成二氧化碳质量为mg。通过计算并分析实验数据确定猜想3成立,则m的取值范围为__________(计算结果用分数表示)。
(结论分析)
探究后他们查到该白色粉末的成分为碳酸氢钠。那么你认为白色粉末中的碳酸钠是如何产生的?写出产生碳酸钠的化学方程式__________。