题目内容
【题目】能源的开采、开发、储存和综合利用是目前世界各国科学家研究的重大课题。
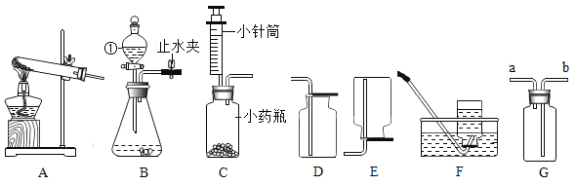
(1)化石燃料中,_____________是比较清洁的能源,其主要成分完全燃烧的化学方程式为___________。
(2)海底蕴含大量可燃冰,可燃冰属于__________(填“可再生”或“不可再生”)能源。
(3)发射卫星的火箭用联氨(N2H4)作燃料,以四氧化二氮作助燃剂,生成氮气与水蒸气。该过程的化学方程式为_______。
【答案】天然气 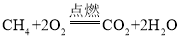 不可再生
不可再生 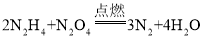
【解析】
(1)化石燃料中天然气是比较清洁的能源,其主要成分为甲烷,其燃烧生成二氧化碳和水,反应的化学方程式是: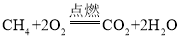 。
。
(2)可燃冰是化石燃料,属于不可再生能源;
(3)联氨(N2H4)作燃料,以四氧化二氮作助燃剂,燃烧尾气由氮气与水蒸气组成,反应的化学方程式为: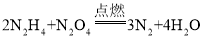 。
。

【题目】蚊虫叮咬时,会分泌蚁酸.化学小组同学对蚁酸产生了浓厚的兴趣,决定对其进行探究.
[提出问题]蚁酸的成分是什么?它有什么性质?
[查阅资料]I蚁酸的化学名称叫甲酸,化学式为HCOOH
II蚁酸隔绝空气并加热时会分解生成两种氧化物
Ⅲ浓硫酸具有吸水性
[实验探究](1)向盛有蚁酸溶液的试管中滴加紫色石蕊试液,观察到溶液颜色变成_____色,说明蚁酸显酸性.
(2)小芳同学根据蚁酸中含有______元素,推测出蚁酸在隔绝空气并加热分解时生成水.
(3)对它分解生成的另一种氧化物,小敏提出两种猜想:猜想Ⅰ是CO2; 猜想Ⅱ是____________;
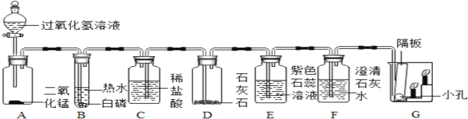
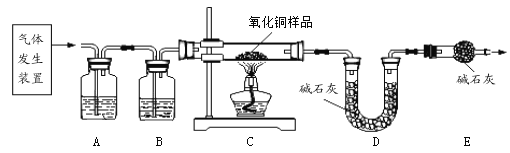
他们按如图所示进行实验:先向装置中通入一会N2,再将蚁酸分解产生的气体通入其中.
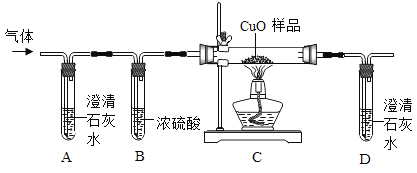
①先通N2的目的是_________________;
②若装置A中无明显变化,则猜想Ⅰ________(填“成立”或“不成立”);
③装置C发生反应的方程式为_______________________;
④装置D中的现象为_________________________;
[结论]甲酸受热能分解,反应的化学方程式是____________________;
[讨论交流]从环保角度看,该装置存在的明显缺陷是_________________.
[拓展延伸]小组同学利用蚁酸分解产生的气体,测定C装置中10g氧化铜样品(杂质不参与反应)中氧化铜的质量分数,在不同时刻测定C中固体的质量(如表):
反应时间/min | 2 | 4 | 6 | 8 | 10 |
固体质量/g | 9.3 | 8.8 | 8.5 | 8.4 | 8.4 |
分析表中数据,完成以下问题:
①在称量质量过程中,必须把玻璃管两端封住,目的是_________________;
②样品中氧化铜的质量分数是________________?