题目内容
【题目】某实验小组用如下装置进行CO还原CuO的实验。试回答以下问题:

(1)实验开始时,应先进行的操作是______________(填“通入CO”或“加热氧化铜”)。
(2)指出该实验中能证明发生了化学变化的证据为______________(写一条)。
(3)C处放有点燃的酒精灯,是为了防止CO污染空气,反应的化学方程式为_____________。
(4)实验结束时,先撤离酒精灯,继续通入CO,直到玻璃管冷却,其目的是______________。
【答案】通入CO A中黑色粉末变成红色,或B中澄清石灰水变浑浊 2CO+O2![]() 2CO2 防止生成的灼热铜重新被氧化
2CO2 防止生成的灼热铜重新被氧化
【解析】
(1)一氧化碳为可燃性气体,实验开始时,应先排尽装置内的空气,以防加热时发生爆炸,应先进行的操作是通入CO。
(2)一氧化碳和黑色氧化铜在加热的条件下生成红色的铜和二氧化碳,二氧化碳能使澄清石灰水变浑浊,证明发生了化学变化的证据是:A中黑色粉末变成红色,或B中澄清石灰水变浑浊。
(3)C处放有点燃的酒精灯,是为了防止CO污染空气,一氧化碳燃烧生成二氧化碳,反应的化学方程式为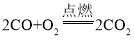 。
。
(4)实验结束时,先撤离酒精灯,继续通入CO,直到玻璃管冷却,其目的是防止生成的灼热铜重新被氧化。

 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案【题目】一定条件下,在密闭容器内投入SO2、O2、SO3、V2O5四种物质,发生反应的化学方程式为2SO2+O2![]() 2SO3。在不同时刻测得容器内各物质的质量如下表所示,下列说法不正确的是
2SO3。在不同时刻测得容器内各物质的质量如下表所示,下列说法不正确的是
物质 | 甲 | 乙 | 丙 | 丁 |
t1 | 80g | 5g | 100g | 5g |
t2 | a | 55g | 60g | b |
t3 | c | d | 40g | 5g |
A.甲是O2,丁是V2O5
B.a = 70g,d = 25g
C.参加反应的SO2、O2的分子个数比为2︰1
D.参加反应的SO2、O2的质量比为4︰1
【题目】在测定空气中氧气含量的实验中,小强采用了如图所示装置:在由两个注射器组成的密闭系统中留有![]() 空气,给装有细铜丝的玻璃管加热,同时交替缓慢推动两个注射器活塞,直到玻璃管内的铜丝在较长时间内无明显变化时停止加热,待冷却至室温后,将气体全部推至一个注射器内,观察密闭系统内气体体积的变化。
空气,给装有细铜丝的玻璃管加热,同时交替缓慢推动两个注射器活塞,直到玻璃管内的铜丝在较长时间内无明显变化时停止加热,待冷却至室温后,将气体全部推至一个注射器内,观察密闭系统内气体体积的变化。
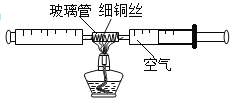
(1)在实验加热过程中,交替缓慢推动两个注射器活塞的目的是______。
(2)写出该实验中反应的文字表达式:______。
(3)小强测得的实验结果如下:
反应前注射器内气体总体积 | 反应后注射器内气体总体积 |
|
|
由此数据可以推算出他测定的空气中氧气的体积分数______(填“![]() ”、“
”、“![]() ”或“
”或“![]() ”)
”)![]() 。造成该实验出现误差的原因可能是______(填序号)。
。造成该实验出现误差的原因可能是______(填序号)。
①没有交替缓慢推动两个注射器活塞
②读数时没有冷却至室温
③加入铜丝量太少
④加入铜丝量太多
(4)通过上面的实验,你学到的测量混合物中某成分含量的方法是______。