题目内容
【题目】通过下列实验装置探究碳及其化合物的性质。
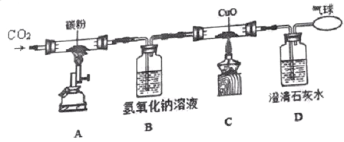
①装置 A 中反应的化学方程式为_____。
②装置 B 中氢氧化钠溶液的作用是_____。
③装置 C 中黑色固体变红色,其化学方程式为_____。
④下列对该实验的分析正确的是_____(选填编号)。
I.给装置 A 中通入 0.1mol 二氧化碳,装置 C 中可生成 0.2mol 铜
II.装置 C 中固体减少的质量与装置 D 中增加的质量相等
III.实验结束时应先熄灭 C 处酒精灯
IV.反应结束后继续通入二氧化碳的目的是防止铜被氧化
【答案】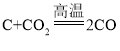 吸收剩余的 CO2
吸收剩余的 CO2 ![]() III
III
【解析】
①装置A中反应为二氧化碳和碳单质在高温下反应生成一氧化碳,;反应的化学方程式为![]() ;
;
②氢氧化钠可以和二氧化碳反应,故装置B中氢氧化钠溶液的作用是吸收剩余的CO2;
③装置C中黑色固体氧化铜与一氧化碳反应生成红色铜单质和二氧化碳,化学反应方程式为![]() ;
;
④I、根据反应![]() ,
,![]() 可知,给装置A中通入0.1mol二氧化碳,装置C中不一定生成0.2mol铜,因为反应物碳和氧化铜的量没有确定,故选项错误;
可知,给装置A中通入0.1mol二氧化碳,装置C中不一定生成0.2mol铜,因为反应物碳和氧化铜的量没有确定,故选项错误;
II、根据装置C出的反应,![]() ,装置C中固体减少的质量为一份氧原子的质量,装置D中增加的质量为一份二氧化碳的质量,两者不相等,故选项错误;
,装置C中固体减少的质量为一份氧原子的质量,装置D中增加的质量为一份二氧化碳的质量,两者不相等,故选项错误;
III、实验结束时为防止倒吸应先熄灭C处酒精灯,冷却再熄灭A的酒精喷灯,故选项正确;
IV、反应结束后继续通入二氧化碳的目的是将一氧化碳全部排至气球中,防止污染空气。

 导学教程高中新课标系列答案
导学教程高中新课标系列答案【题目】化学实验活动课上,同学们利用了如图所示实验探究氢氧化钙的性质。
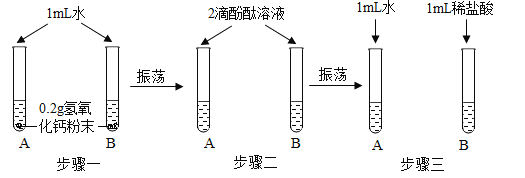
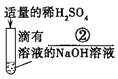
(1)上述三个步骤的A试管中固体始终无明显减少,那么能说明A试管的水中溶有氢氧化钙的现象是__________。
(2)步骤三试管B中溶液变无色,发生反应的化学方程式_______________。
小明的实验:小明直接把稀盐酸滴入盛有氢氧化钙溶液的试管中,始终没有看到明显变化。
(提出问题)小明实验后试管中溶质的成分是什么?
(查阅资料)CaCl2溶液显中性。
(猜想与假设)针对疑问,甲组同学猜想如下:
猜想I:只有CaCl2猜想Ⅱ有________
猜想Ⅲ:有CaCl2和Ca(OH)2
猜想Ⅳ:有CaCl2、HCl和Ca(OH)2
乙组同学对以上猜想提出质疑,认为猜想Ⅳ不合理,其理由是_____________
(实验探究)为了验证其余猜想,各小组进行了下列三个方案的探究。
实验方案 | 滴加紫色石蕊试液 | 通入CO2 | 滴加Na2CO3 |
实验操作 |
|
|
|
实验现象 | _________ | __________ | 产生白色沉淀 |
实验结论 | 溶液中含有Ca(OH)2 | 溶液中含有Ca(OH)2 | 溶液中含有Ca(OH)2 |
(得出结论)通过探究,全班同学一致确定猜想Ⅲ是正确的。
(评价反思)丙组同学认为滴加Na2CO3溶液产生白色沉淀,并不能证明溶液中一定含有Ca(OH)2,请你帮助他们说明原因_____________。
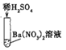
【题目】小明在实验室发现一瓶未知浓度的氢氧化钠溶液,为方便以后使用,他对其浓度进行了测定。取20g此氢氧化钠溶液于烧杯中,逐滴滴加溶质质量分数为9.8%的稀硫酸,并随时对反应后的溶液用pH计(一种测定溶液pH的仪器)测定溶液的pH,所得数据如下表:
加入稀硫酸的质量/g | 9.6 | 9.8 | 9.9 | 10 | 10.1 |
溶液的pH | 12.4 | 12.1 | 11.8 | 7 | 2.2 |
(1)当滴加稀硫酸的质量为9.8g时,溶液中的溶质有__________;
(2)计算所测氢氧化钠溶液中溶质的质量分数_________。
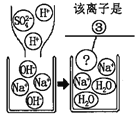
【题目】某化学兴趣小组的同学们在实验室里探究某些酸、碱、盐之间是否发生复分解反应。
(查阅资料)硫酸钡(BaSO4)白色固体,不溶于水,也不溶于盐酸、硫酸和硝酸。
(实验与探究)
内容 | 现象 | 实验解析 | 结论 | |
实验一 |
| _____ | 化学方程式是: K2CO3+H2SO4=K2SO4+H2O+CO2↑ | 生成物中有气体或有__或有沉淀生成时,复分解反应可以发生。 |
实验二 |
_____ | 溶液颜色由红色恰好变为无色 |
| |
实验三 |
| 产生白色沉淀 | 该反应的实质是: Ba2++SO42-=BaSO4↓ |
实验三结束后,某同学出于好奇,把实验三试管里的上层清液a倒入另一支洁净的试管中,向清液a中逐滴滴加K2CO3溶液。在滴加过程中,发现先产生气泡,然后又产生白色沉淀。根据上述现象,请你判断原清液a中的溶质是_____。
(拓展与应用)将稀盐酸Ca(OH)2溶液NaCl溶液Na2CO3溶液任意两种溶液相混合,写出能发生反应且有沉淀生成的化学方程式________。