题目内容
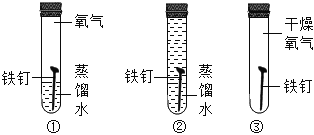
【题目】某化学兴趣小组的同学们在实验室里探究某些酸、碱、盐之间是否发生复分解反应。
(查阅资料)硫酸钡(BaSO4)白色固体,不溶于水,也不溶于盐酸、硫酸和硝酸。
(实验与探究)
内容 | 现象 | 实验解析 | 结论 | |
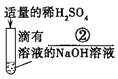
实验一 |
| _____ | 化学方程式是: K2CO3+H2SO4=K2SO4+H2O+CO2↑ | 生成物中有气体或有__或有沉淀生成时,复分解反应可以发生。 |
实验二 |
_____ | 溶液颜色由红色恰好变为无色 |
| |
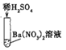
实验三 |
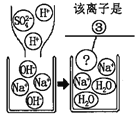
| 产生白色沉淀 | 该反应的实质是: Ba2++SO42-=BaSO4↓ |
实验三结束后,某同学出于好奇,把实验三试管里的上层清液a倒入另一支洁净的试管中,向清液a中逐滴滴加K2CO3溶液。在滴加过程中,发现先产生气泡,然后又产生白色沉淀。根据上述现象,请你判断原清液a中的溶质是_____。
(拓展与应用)将稀盐酸Ca(OH)2溶液NaCl溶液Na2CO3溶液任意两种溶液相混合,写出能发生反应且有沉淀生成的化学方程式________。
【答案】 有气泡产生 酚酞 SO42-(或硫酸根离子或硫酸根均可) 水(或H2O) HNO3和Ba(NO3)2(或硝酸和硝酸钡) Ca(OH)2+Na2CO3==CaCO3↓+2NaOH
【解析】【实验与探究】实验一:碳酸盐和酸反应会生成二氧化碳,所以将稀硫酸滴入有碳酸钾溶液的试管中会有气泡产生;
实验二:氢氧化钠和硫酸反应没有现象,可以借助指示剂判断反映的发生,酚酞遇碱变红色,在中性或酸性时为无色;酸碱中和的实质是氢离子与氢氧根离子结合为水分子,反应中钠离子和硫酸根离子没有改变,故填:酚酞;SO42-;
结论:有三个实验可以看出,生成物中有气体或有水或有沉淀生成时,复分解反应可以发生。
氢离子和碳酸根离子反应会生成二氧化碳,钡离子和碳酸根离子反应会生成碳酸钡沉淀,所以把实验三试管里的上层清液a倒入另一支洁净的试管中,向清液a中逐滴滴加K2CO3溶液。在滴加过程中,发现先产生气泡,然后又产生白色沉淀。根据上述现象,请你判断原清液a中的溶质是HNO3和Ba(NO3)2;
【拓展与应用】氯化钠与另外三种物质交换成分没有气体或有水或有沉淀,所以不会反应;稀盐酸与Na2CO3溶液生成氯化钠、水和二氧化碳气体,无沉淀;氢氧化钙和碳酸钠反应生成碳酸钙沉淀和氢氧化钠,化学方程式为:Ca(OH)2+Na2CO3═CaCO3↓+2NaOH。

 轻松课堂单元期中期末专题冲刺100分系列答案
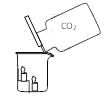
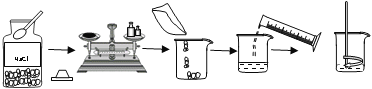
轻松课堂单元期中期末专题冲刺100分系列答案【题目】实验是学习化学的重要手段,请结合下图所示实验回答相应问题。
|
|
|
实验一 | 实验二 | 实验三 |
(1)实验一中观察到蜡烛由低到高依次熄灭,说明二氧化碳具有的性质是_________________________。
(2)实验二是配制50g质量分数为6%的氯化钠溶液的实验,应称取NaCI的质量为____g,某同学在量取液体体积时俯视读数,这样会使所配溶液的质量分数 ___6%(填“大于”,“等于”或“小于”)。
(3)实验三是电解水的实验,该实验说明水是由______________组成的。