题目内容
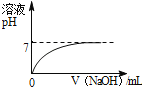
【题目】小明在实验室发现一瓶未知浓度的氢氧化钠溶液,为方便以后使用,他对其浓度进行了测定。取20g此氢氧化钠溶液于烧杯中,逐滴滴加溶质质量分数为9.8%的稀硫酸,并随时对反应后的溶液用pH计(一种测定溶液pH的仪器)测定溶液的pH,所得数据如下表:
加入稀硫酸的质量/g | 9.6 | 9.8 | 9.9 | 10 | 10.1 |
溶液的pH | 12.4 | 12.1 | 11.8 | 7 | 2.2 |
(1)当滴加稀硫酸的质量为9.8g时,溶液中的溶质有__________;
(2)计算所测氢氧化钠溶液中溶质的质量分数_________。
【答案】氢氧化钠和硫酸钠 4%
【解析】
(1)由表可知,当滴加稀硫酸的质量为9.8g时,溶液的pH值为12.1,pH>7,溶液显碱性,说明氢氧化钠未完全反应,氢氧化钠与稀硫酸反应生成硫酸钠和水,故溶液中的溶质是:氢氧化钠和硫酸钠;
(2)由表可知,当滴加稀硫酸的质量为10g时,溶液的pH=7,说明这时,氢氧化钠和稀硫酸恰好完全反应,设氢氧化钠溶液中溶质的质量分数为x
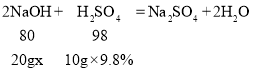
![]()
x=4%
答:氢氧化钠溶液中溶质的质量分数为4%。

练习册系列答案
相关题目
【题目】某同学为测定黄铜屑(由锌和铜形成的合金)样品组。分四次取样品与稀盐酸反应,其实验数据记录见下表。
1 | 2 | 3 | 4 | |
取样品质量(g) | 50.0 | 50.0 | 50.0 | 50.0 |
取稀硫酸质量(g) | 40.0 | 80.0 | 120.0 | 160.0 |
产生气体质量(g) | 0.4 | 0.8 | 1.0 | 1.0 |
试计算:
①第几次实验金属锌完全反应________。
②所用稀硫酸中溶质的质量分数_______?