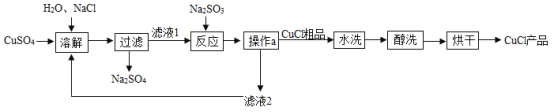
题目内容
【题目】某工厂的废水中含有MgSO4和FeCl3,技术人员逐渐加入NaOH溶液调节废水的pH,先后分离出两种沉淀,并通过一系列处理得到有价值的产品。操作流程如下图所示。
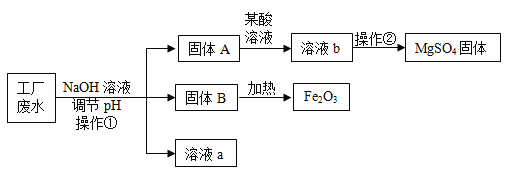
(1)固体A与某酸反应的化学方程式为_____,操作②的名称是_____。
(2)固体B加热的产物是两种常见氧化物,则另一种氧化物的化学式为_____。
(3)溶液a除了可能含有NaOH外,还一定含有的溶质是_____(填化学式)。
【答案】![]() 蒸发结晶 H2O NaCl、Na2SO4
蒸发结晶 H2O NaCl、Na2SO4
【解析】
工业废水加入氢氧化钠溶液,则会与硫酸镁反应生成氢氧化镁沉淀和硫酸钠,与氯化铁反应生成氢氧化铁沉淀和氯化钠。A中加入某酸以后得到的是硫酸镁,故酸是硫酸,固体A是氢氧化镁。固体B加热得到的是氧化铁,故B是氢氧化铁,溶液a中含有生成的氯化钠和硫酸钠。
(1)通过分析可知,固体A与某酸反应是氢氧化镁与硫酸的反应,生成的是硫酸镁和水,硫酸镁溶液中得到硫酸镁,操作②是蒸发结晶操作。故答案为:![]() 、蒸发结晶;
、蒸发结晶;
(2)通过分析可知,固体B是氢氧化铁。根据质量守恒定律可知,反应后的另一种氧化物应该含有氢元素,则另一种氧化物是水。故答案为:H2O;
(3)通过分析可知,溶液a中含有生成的氯化钠和硫酸钠。故答案为:NaCl、Na2SO4。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】下列对一些事实的解释不正确的是![]()
![]()
事实 | 解释 | |
A | 物质的热胀冷缩 | 分子或原子的大小随温度的改变而改变 |
B | 一氧化碳有可燃性,而二氧化碳不具有可燃性 | 物质组成元素虽然相同,但分子结构也不同 |
C | 水电解产生氢气和氧气 | 分子在化学变化中是可以再分的 |
D |
| 一般都不支持燃烧 |
A. A B. B C. C D. D
【题目】小思在实验室发现一瓶瓶塞破损的淡黄色固体,标签标明该固体是过氧化钠。该固体是否已经变质?于是他和同学们进行了以下实验探究:
[查阅资料]
过氧化钠(化学式为Na2O2)是一种淡黄色固体,常用在呼吸面具和潜水中制氧气,其原理为:
2Na2O2+2CO2═2Na2CO3+O2
2Na2O2+2H2O═4NaOH+O2↑
[分析猜想]美奇同学根据观察并结合所给资料判断。该固体中一定还含有Na2O2,理由是_____。
他进一步对固体成份提出了以下猜想:
①只含Na2O2②含Na2CO3和Na2O2两种物质
③含Na2CO3、NaOH两种物质 ④含Na2O2、Na2CO3和NaOH三种物质
[问题分折]请你说明提出猜想③的依据是_____。
[实验探究]为确定该固体的成份,他们又进行了如下实验:
实验方案与步骤 | 实验现象 | 实验结论 |
①取一定量固体于试管中,加入足量蒸馏水,并将带火星木条伸入试管内 | 现象:有气泡产生,木条燃烧程度增强 | 固体中含有Na2O2. |
②将①所得溶液平均分为两份,向第一份溶液中加入足量稀盐酸 | 现象:_____ | 固体中含Na2CO3 |
③向第二份溶液中加入过量的BaCl2溶液,充分反应后取上层清液滴入无色酚酞 | (1)产生白色沉淀;(2)溶液变红 | 固体中含有NaOH |
请写出实验③中产生白色沉淀的化学方程式:_____。
[反思与交流]
有同学认为通过定量计算可确定固体中是否含有NaOH.具体方案如下:①取一定量固体加入到足量的水中,测定产生氧气的质量。②向①中加入足量的CaCl2溶液,通过_____、洗涤、干燥称量产生沉淀质量,进而计算出固体中含Na2CO3的质量。③判断固体中是否含有NaOH。
【题目】同学们用大理石和稀盐酸制取二氧化碳后,小欣同学发现容器内液体是浑浊的,她很好奇,浑浊液体是什么?于是她和同学们一起将浑浊的液体过滤,得到滤液和固体,并对此展开了探究(溶解于水中的气体成分忽略不计)
[提出问题)滤液中的溶质以及过滤得到的固体的成分是什么?
[查阅资料]①大理石中含有SiO2(不溶于水,且不与盐酸反应),可能含有少量的Fe2O3等。②FeCl3 溶液遇到硫氰化钾(KSCN)溶液能够很灵敏显现出红色。
[猜想验证]
Ⅰ经讨论,大家认为滤液中一定含有CaCl2原因是______________(用化学方程式表示),若产生8.8 克CO2 (不考虑其溶于水或与水反应)则生成CaCl2的质量为_______________。
Ⅱ小欣同学根据资料中大理石的成分,猜想滤液中可能含有少量_______________。
她取少量滤液于试管中,滴加硫氰化钾(KSCN)溶液,观察到滤液颜色无变化,由此得出的结论是_______________。
Ⅲ小雨又提出猜想,滤液中还可能含有_______________(填化学式)。请你和小雨一起验证他的猜想。
实验操作 | 实验现象 | 实验结论 |
取少量滤液于试管中,向其中滴加____________________。 | 溶液变成红色 | 小雨的猜想成立 |
[得出结论]最终同学们确定了滤液中的溶质以及过滤得到的固体的成分。