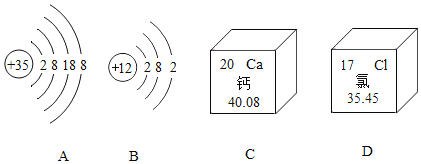
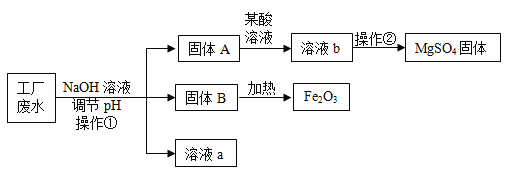
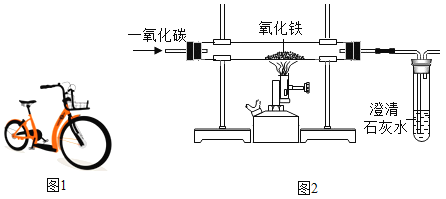
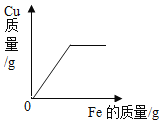
题目内容
【题目】氯化亚铜(CuCl)广泛应用于冶金、电镀等行业。已知 CuCl 难溶于水和乙醇,在潮湿空气中易变质。CuCl 的制备流程如下:
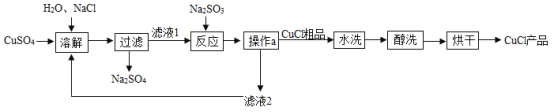
(1)“反应”中发生的化学变化是 2CuCl2+Na2SO3=2CuCl↓+2X+SO3,X 的化学式为_____,SO3 与水化合生成一种酸,该反应的化学方程式为_____。
(2)“操作 a”的名称是_____。
(3)160 g CuSO4 与足量 NaCl 经上述制备流程,可生成的 CuCl 最多是_____g。
【答案】NaCl SO3+H2O=H2SO4 过滤 99.5
【解析】
(1)根据质量守恒定律,化学反应前后原子的种类和个数不变,化学方程式2CuCl2+Na2SO3=2CuCl↓+2X+SO3中,X 的化学式为NaCl;产生的SO3迅速与水化合生成硫酸,该反应的化学方程式为:SO3+H2O═H2SO4.故填:NaCl;SO3+H2O═H2SO4。
(2)“操作a”的名称是过滤,通过过滤把液体和固体分离。故填:过滤;
(3)160gCuSO4中铜元素质量为:160g×![]() ×100%=64g,因为硫酸铜的铜元素完全转化到了氯化亚铜中,因此足量NaCl经上述制备流程,可生成的CuCl最多是:64g÷(
×100%=64g,因为硫酸铜的铜元素完全转化到了氯化亚铜中,因此足量NaCl经上述制备流程,可生成的CuCl最多是:64g÷(![]() ×100%)=99.5g,故填:99.5。
×100%)=99.5g,故填:99.5。

 寒假乐园北京教育出版社系列答案
寒假乐园北京教育出版社系列答案【题目】某兴趣小组对石灰石样品进行如下实验取12g样品放入烧杯中,将100g稀盐酸分4次加入到烧杯中,充分反应后(杂质不溶于水,也不与酸反应),测得剩余固体的质量记录如下。请计算:
次数 | 1 | 2 | 3 | 4 |
加入稀盐酸的质量/g | 25 | 25 | 25 | 25 |
剩余固体的质量/g | 8 | 4 | 2 | 2 |
求:
(1)样品中碳酸钙的质量为_____g:
(2)第4次加入稀盐酸后所得溶液中CaCl2的质量分数_______。(写出计算过程,最终结果保留0.1%)。
【题目】做完加热铜片的实验后,小明同学对其成分进行分析。取10g此样品,向其中分五次加入相同溶质质量分数的稀硫酸,使之充分反应,每次所用稀硫酸的质量及剩余固体的质量记录于下表:
第一次 | 第二次 | 第三次 | 第四次 | 第五次 | |
加入稀硫酸的质量/g | 20 | 20 | 20 | 20 | 20 |
充分反应后剩余固体的质量/g | 9.2 | 8.4 | 7.6 | 7 | 7 |
试回答下列问题:
(1)10g样品中氧化铜的质量为__________g。
(2)计算所加入稀硫酸中溶质的质量分数____________________。