题目内容
【题目】甲、乙两种固体的溶解度曲线如右下图。将①②两试管中的甲、乙饱和溶液(均有少量未溶解的固体)放进盛有热水的烧杯里。升高温度后,下列有关说法正确的是( )
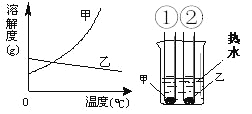
A. ①②两溶液的质量一定相等
B. ①②两溶液均变为不饱和溶液
C. ①溶液质量增加,②溶液质量减少
D. ①溶液中溶质的质量分数一定大于②溶液
【答案】C
【解析】A、升高温度后,①试管内固体溶质继续溶解,溶液质量增加,②试管内析出晶体,溶液质量减小;故①②两溶液的质量一定相等的判断不正确;故A不正确;
B、升高温度后,②试管内析出晶体,溶液变成高温下的饱和溶液;①试管内固体溶质继续溶解,是否达到饱和无法判断;故①②两溶液均变为不饱和溶液的判断不正确;故B不正确;
C、升高温度后,①试管内固体溶质继续溶解,溶液质量增加,②试管内析出晶体,溶液质量减小;故①溶液质量增加,②溶液质量减少的判断符合实际变化情况;故C正确;
D、升高温度后,①试管内固体溶质继续溶解,溶液质量增加,②试管内析出晶体,溶液质量减小;但由于不能确切判断溶液中溶质质量的大小关系,故①溶液中溶质的质量分数一定大于②溶液的判断不正确;故D不正确;
故选C.

【题目】铁、铝、铜是常见的三种金属。同学们发现生活中的铝和铜制品表面一般不用防锈,而铁制品一般需要做防锈处理。
【提出问题】这是不是因为铁、铝、铜三种金属中铁的活动性最强呢?
【实验探究】同学们对这三种金属的活动性顺序展开了探究,请你参与探究并填写空格。
将粗细相同的铁丝、铝丝、铜丝分别插入体积相同、溶质质量分数也相同的稀盐酸中:
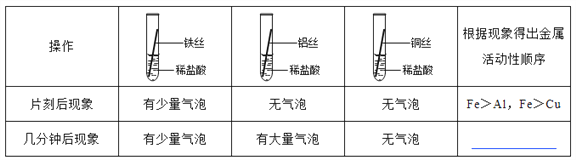
__________________
【讨论交流】为什么同一个实验得出了两种结论呢?同学们带着这个疑问查阅了相关资料,明白了铝丝在稀盐酸中短时间内无气泡,是因为铝表面致密的氧化膜会先与盐酸反应。
【反思评价】做金属性质实验时需将金属进行打磨,打磨的目的是__________________________,
铁与盐酸反应的方程式是_________________________________________________。
【实验验证】为了进一步确认铁、铝、铜这三种金属的活动性顺序,同学们又将两根粗细相同的、 打磨过的铁丝分别插入硫酸铝溶液、硫酸铜溶液中:
操作 |
|
| 根据现象得出金属活动性顺序 |
现象 | 无明显现象 | ______________________ | Al>Fe>Cu |
写出铁与硫酸铜溶液反应的化学方程式______________________________________________。
【拓展迁移】若只有一支盛有少量稀盐酸的试管,只需合理安排金属丝的插入顺序(能与盐酸反应的要一次将盐酸消耗完),也能证明铁、铝、铜这三种金属的活动性顺序。金属丝的插入顺序为________________________________________________。