题目内容
【题目】A,B,C三种不含结晶水的固体物质的溶解度曲线如图,下列说法中不正确的是( )
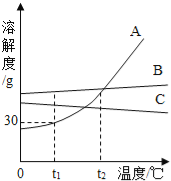
A. t1℃时,A的饱和溶液65g中含有溶剂50g
B. 将t2℃A,B,C三种物质的饱和溶液降温至t1℃时,C溶液中溶质的质量分数保持不变
C. 在t2℃,A,B两种溶液中溶质的质量分数相同
D. 要从B溶液中得到B,通常可采用蒸发溶剂使其结晶的方法
【答案】C
【解析】A、由于在t1℃时,A的溶解度是30g,即在100克水中最多溶解30克A,则在50克水中最多溶解15克A,即在t1℃时,A的65克饱和溶液中含有溶剂50克,故A正确;
B、由于C的溶解度随温度的降低而增大,因此将t2℃A,B,C三种物质的饱和溶液降温至t1℃时,C的饱和溶液就会变成不饱和溶液,但C溶液中溶质的质量分数保持不变,故B正确;
C、由于在t2℃时,A和B的溶解度相等,但是由于两者是否处于饱和状态无法确定,所以质量分数是否相等无法确定.故C错误;
D、由于B的溶解度受温度的影响很小,因此应采取蒸发溶剂的方法从溶液中得到晶体,故D正确;
故选C.

 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案【题目】1941年,侯德榜(如图)向氨水(NH3·H2O)中通入足量的二氧化碳,再向所得的溶液中加入NaCl使其溶解,结果发现在常温下析出一种白色固体。

[提出问题]析出的白色固体是什么?
[进行猜想]①NH4Cl;②(NH4)2CO3;③NH4HCO3;④Na2CO3;⑤NaHCO3
[收集证据]佐证一:设计实验,检验析出的白色固体是上述猜想中的哪一种物质?首先向白色固体中滴加氢氧化钠溶液,并微热,没有察觉到(1)___________现象,说明不是铵盐。
当检验是哪种钠盐时,做对比实验。取过量的碳酸钠、碳酸氢钠和析出的白色粉末三种物质,分别装在相同的三个气球中,再将瘪气球系紧在装有等量的盐酸的试管口上,并做如下实验(如图)

B和C产生的气体体积相等,该气体是(2)_______,则侯德榜实验中,析出的白色粉末的是(3)_________。
佐证二:查找上述五种物质在常温下的溶解度资料是:
①NH4Cl | ②(NH4)2CO3 | ③NH4HCO3 | ④Na2CO3 | ⑤NaHCO3 |
37.2g | 100g | 21.7g | 21.5g | 9.6g |
通过溶解度分析判断,析出的白色固体与上述实验判断的物质相同。
[反思交流] 1.通过溶解度判断析出的物质也是(3)的结论,理由是(4)______________;
2.在化肥中没有碳酸铵,原因之一是碳酸铵在空气中,吸收某些成分会变成碳酸氢铵。反应方程式为(5)_____。
3.侯德榜实验析出一种白色固体,过滤出固体,得到滤液。要检验滤液中含有Cl—和CO32—,你检验的方法是 (6)________。
【题目】化学与生活密切相关,生活中蕴含着丰富的化学知识。
(1)蛋糕是一种美味又营养的食品,其制作原料主要有:鸡蛋、面粉、白砂糖、牛奶、橄榄油等,其中富含糖类的有白砂糖和_________。
(2)厨房中的铁锅清洗后一般要擦干放置,可以减少_______对铁锈蚀的影响。
(3)河水净化的主要步骤如下图所示:
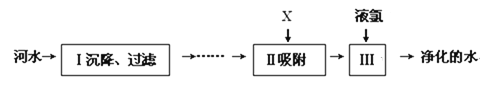
步骤Ⅱ吸附加入的X试剂可以是__________;用___________可以判断净化的水是硬水还是软水。
(4)家庭常用的几种清洁剂及主要成分如下:
常用的清洁剂 | 除垢净 | 去污粉 | 管道通 |
主要成分 | 盐酸 | 碳酸钠 | 氢氧化钠、铝粉 |
除垢净既能除水垢也能去铁锈,请写出除垢净去铁锈的反应方程式___________________.
②去污粉与除垢净不能混合使用,其原因是________________(用化学方程式表示)。③管道通使用时不能接触皮肤,原因是___________。使用时Al与NaOH溶液反应放出大量的热,可加快NaOH与淤积物的作用。在反应产物NaAlO2中,铝元素的化合价为___价。
(5)下图是燃气热水器示意图。根据此图回答:
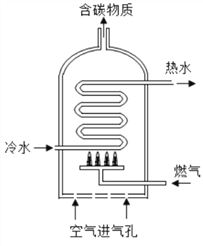
①某热水器以天热气为燃气。写出其完全燃烧的化学方程式___________.
②“空气进气孔”被部分堵塞时,燃烧将产生有毒气体M。M的化学式为__________。