题目内容
(7分) 工业用碳酸钠溶液与石灰水反应制烧碱。对于碳酸钠溶液与石灰水是否恰好完全反应,化学小组同学将其产物进行过滤,并对滤液进行如下探究。
提出假设:假设一:滤液中只含氢氧化钠
假设二:滤液中含氢氧化钠和氢氧化钙
假设三:滤液中含氢氧化钠和碳酸钠
假设四:滤液中含氢氧化钠、氢氧化钙和碳酸钠
甲同学设计了如下实验方案:已知:Na2CO3 + CaCl2= 2NaCl+CaCO3↓(白色)
试回答:
(1)写出碳酸钠溶液与石灰水反应的化学方程式 。
(2)哪种假设不合理,试说明理由 。
(3)乙同学认为甲同学设计方案还不能说明碳酸钠溶液和澄清石灰水恰好完全反应,她的理由是 。
(4)丙同学认为要说明碳酸钠溶液与石灰水是否恰好完全反应,还需在甲同学实验方案的基础上进行实验。她的实验方案是:
(5)取18.6g氢氧化钠样品(样品中的杂质是碳酸钠),加水溶解得到溶液A,取A溶液的1/10向其中逐滴加入一定浓度的稀盐酸,并同时记录放出CO2的质量和消耗盐酸的质量(所得数据如右图)。试计算:

①盐酸中溶质的质量分数为 。
②样品中碳元素的质量分数为 。
提出假设:假设一:滤液中只含氢氧化钠
假设二:滤液中含氢氧化钠和氢氧化钙
假设三:滤液中含氢氧化钠和碳酸钠
假设四:滤液中含氢氧化钠、氢氧化钙和碳酸钠
甲同学设计了如下实验方案:已知:Na2CO3 + CaCl2= 2NaCl+CaCO3↓(白色)
| 实验步骤 | 实验现象 | 结论 |
| 取少量滤液放在试管中,再滴入氯化钙溶液 | 若生成白色沉淀 | 碳酸钠过量 |
| 若无明显现象 | 恰好反应 |
(1)写出碳酸钠溶液与石灰水反应的化学方程式 。
(2)哪种假设不合理,试说明理由 。
(3)乙同学认为甲同学设计方案还不能说明碳酸钠溶液和澄清石灰水恰好完全反应,她的理由是 。
(4)丙同学认为要说明碳酸钠溶液与石灰水是否恰好完全反应,还需在甲同学实验方案的基础上进行实验。她的实验方案是:
| 实验步骤 | 实验现象和结论 |
| | |
| |

①盐酸中溶质的质量分数为 。
②样品中碳元素的质量分数为 。
(1)Na2CO3+Ca(OH)2="===" CaCO3↓+2NaOH
(2)假设四不合理,因为氢氧化钙溶液与碳酸钠溶液不能共存。
(3)若氢氧化钙过量与氯化钙不发生反应
(4)
(5)10% 6.5%
(2)假设四不合理,因为氢氧化钙溶液与碳酸钠溶液不能共存。
(3)若氢氧化钙过量与氯化钙不发生反应
(4)
| 实 验 步 骤 | 实 验 现 象 和 结 论 |
| 取甲同学实验后的清液放在试管中,在通入足量的二氧化碳(或滴入Na2CO3溶液),观察 | 溶液无变化,则不含氢氧化钙 |
| 溶液变浑浊,则含氢氧化钙 |
试题分析:(1)碳酸钠和氢氧化钙发生的是复分解反应,生成碳酸钙沉淀和氢氧化钠,故化学方程式为Na2CO3+Ca(OH)2= CaCO3↓+2NaOH;
(2)对反应后溶液中的物质进行假设,要从两个方面来思考,一是恰好完全反应,二是有一种反应物过量,不可能两种反应物都过量,很显然假设四不成立,因为碳酸钠和氢氧化钙是反应物,二者不可能都剩余;
(3)甲同学的方案还不能说明碳酸钠溶液和澄清石灰水恰好完全反应,因为如果是假设二成立,过量的氢氧化钙和氯化钙也不反应,无现象;
(4)在甲同学实验方案的基础上,要说明碳酸钠溶液与石灰水恰好完全反应,关键是要验证反应后的溶液中是否含有氢氧化钙,故应取甲同学实验后的清液放在试管中,再通入足量的二氧化碳,如果溶液变浑浊,说明滤液中含氢氧化钙;如果溶液无变化,说明不含氢氧化钙;
(5)含碳酸钠杂质的氢氧化钠样品中加入稀盐酸后,首先发生的是酸碱中和反应,其次才发生碳酸钠和盐酸的反应;样品中的碳元素最终都转化到了二氧化碳中,所以求样品中碳元素质量分数,要先找出二氧化碳中碳元素质量。
①设盐酸溶质的质量分数为x
Na2CO3+2HCl═2NaCl+H2O+CO2↑
73 44
(14.6g-7.3g)x 0.44g
73 :44 =(16.4g-7.3g)x: 0.44g
解得,x=10%
②0.44g二氧化碳中碳元素的质量为:0.44g×
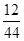 =0.12g;
=0.12g;则18.6g样品中所含的碳元素的质量为:0.12g×10=1.2g;
所以样品中碳元素的质量分数为:
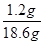 ×100%=6.5%
×100%=6.5%点评:此题是有关反应后溶液中成分的探究题,其中又有根据化学方程式的计算,步骤较多,做题过程比较繁琐,属于较难题型。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目