题目内容
(7分)某校化学兴趣小组的同学对敞口放置的固体烧碱的变质程度开展了探究。
写出烧碱发生变质反应的化学方程式______________________________________。
为确定固体混合物中碳酸钠的质量分数,他们设计了如下几种不同的实验方案:
[方案一] 气体分析法。

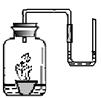
(1)若用图甲中的收集装置,则所测CO2气体的体积________(填“偏大”、“偏小”、“不变”),理由是 ,你的改进措施是 。
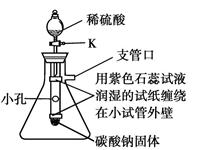
(2)若用乙装置测定CO2的质量(碱石灰是CaO和NaOH的混合物)。该实验设计中的缺陷是 (答一点即可)。
[方案二]沉淀分析法。
资料:部分碱和盐的溶解性表(20℃)

发生反应的化学方程式是 ,溶液M中的溶质是 。
写出烧碱发生变质反应的化学方程式______________________________________。
为确定固体混合物中碳酸钠的质量分数,他们设计了如下几种不同的实验方案:
[方案一] 气体分析法。

(1)若用图甲中的收集装置,则所测CO2气体的体积________(填“偏大”、“偏小”、“不变”),理由是 ,你的改进措施是 。
(2)若用乙装置测定CO2的质量(碱石灰是CaO和NaOH的混合物)。该实验设计中的缺陷是 (答一点即可)。
[方案二]沉淀分析法。
资料:部分碱和盐的溶解性表(20℃)
| | OH– | Cl- | CO32- | SO42- |
| Ca2+ | 微 | 溶 | 不 | 微 |
| Mg2+ | 不 | 溶 | 不 | 溶 |
| Fe3+ | 不 | 溶 | — | 溶 |
| Cu2+ | 不 | 溶 | 不 | 溶 |

发生反应的化学方程式是 ,溶液M中的溶质是 。
2NaOH + CO2 =Na2CO3 + H2O
[方案一](1)偏小 CO2能溶于水且与水反应 在水面上覆盖一层植物油(或将广口瓶中的水改为饱和的CO2水溶液等合理答案)
(2)(答其中一点或其他合理答案均可)
[方案二] Na2CO3 + Ca(OH)2 ="=" CaCO3↓+ 2NaOH NaOH和Ca(OH)2
[方案一](1)偏小 CO2能溶于水且与水反应 在水面上覆盖一层植物油(或将广口瓶中的水改为饱和的CO2水溶液等合理答案)
(2)(答其中一点或其他合理答案均可)
| ①产生的CO2气体中混有水蒸气,同时被碱石灰吸收 | 导致结果偏大 |
| ②反应结束后装置内残留的CO2气体不能全部排出 | 导致结果偏小 |
| ③球形干燥管与空气相通,也会吸收空气中的CO2和水蒸气 | 导致结果偏大 |
试题分析:氢氧化钠是碱,可以和空气中的酸性氧化物二氧化碳反应生成碳酸钠和水,而变质,故烧碱发生变质反应的化学方程式为2NaOH+CO2 =Na2CO3+H2O。
[方案一](1)因为二氧化碳不仅能溶于水,还能与水反应,用排水法收集气体,收集的二氧化碳偏小,为防止二氧化碳接触水,可用隔绝的方法,如在水面上覆盖一层植物油,或将广口瓶中的水改为饱和的CO2水溶液。
(2)反应生成的二氧化碳中含有水分,而碱石灰在吸收二氧化碳的同时,也吸收水分,导致结果偏大;反应结束后装置中残留的二氧化碳没法被碱石灰完全吸收,可能造成二氧化碳的质量偏小,等等。
[方案二]:实验目的是通过将碳酸钠转换为沉淀,测沉淀的质量来计算含量的,所以必须保证碳酸钠全部转换为沉淀,但不能使氢氧化钠转换为沉淀,对比溶解性表可知,只能加澄清的石灰水。故发生反应的化学方程式是Na2CO3 + Ca(OH)2 = CaCO3↓+ 2NaOH,由于所加Z溶液过量,所以溶液M中的溶质是生成的NaOH和剩余的Ca(OH)2。
点评:有关氢氧化钠变质的试题是中考的重要考点,也是难点,对于本题提供的测定碳酸钠的含量的多种方法,要认真研究,并加以运用。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目