题目内容
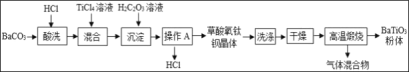
【题目】以下是实验室制取气体的装置图,回答下列问题
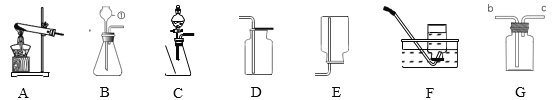
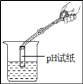
(1)仪器①的名称_____
(2)实验室利用A装置制取氧气的化学方程式_____
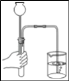
(3)实验室可用装置B或C制取H2,C装置相对于B装置,优点有_____,使用G装置收集H2,气体应从_____(填“b”或“c”)端通入
(4)某化学家根据绿色化学中原子转化利用率为100%的理念,为了同时制备氢气和氧气,设计了如下的各步化学反应(Br相对原子质量80)
①CaBr2+H2O![]() CaO+2HBr ②2HBr+Hg
CaO+2HBr ②2HBr+Hg![]() HgBr2+H2↑
HgBr2+H2↑
③HgBr2+CaO![]() HgO+CaBr2 ④2HgO
HgO+CaBr2 ④2HgO![]() 2Hg+O2↑
2Hg+O2↑
若要通过上述方法制备8g的氧气,理论上需要溴化钙的质量为_____g,上述制备气体的方法中存在的缺点是_____(只写一点即可)
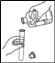
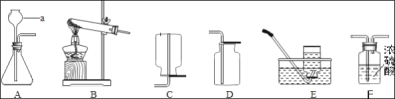
(5)将实验室制得的CO2通入澄清石灰水,石灰水未变浑浊,于是将气体通入下图装置进行探究
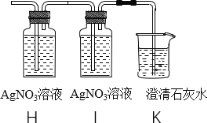
①实验室制取CO2的化学方程式为_____
②装置H、K中溶液变浑浊,I中溶液不变浑浊,则原石灰水未变浑浊的原因是_____
③装置I的作用是_____
【答案】长颈漏斗 ![]() 便于控制反应的速率 c 100 制备过程中使用了汞,可能造成重金属中毒或污染(或反应需要加热,耗费较多能源) CaCO3+2HCl=CaCl2+H2O+CO2↑ 二氧化碳中含有HCl气体 证明氯化氢(HCl)气体已被除尽
便于控制反应的速率 c 100 制备过程中使用了汞,可能造成重金属中毒或污染(或反应需要加热,耗费较多能源) CaCO3+2HCl=CaCl2+H2O+CO2↑ 二氧化碳中含有HCl气体 证明氯化氢(HCl)气体已被除尽
【解析】
(1)据图可知仪器①的名称是:长颈漏斗;
(2)利用A装置制取氧气时,因为试管口没有一团棉花,应该是利用氯酸钾制取氧气,反应的化学方程式为:![]() ;
;
(3)C装置相对于B的优点有:控制反应的发生和停止;用G装置收集H2,气体应从短管进入,因为氢气的密度比空气小;
(4)设制备8g的氧气,理论上需要溴化钙的质量为x,根据元素守恒观,由四个化学方程式得出如下关系:
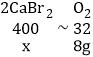
![]()
x=8g;
反应过程中生成汞,所以循环过程需要很高的能量,且使用重金属汞,产生污染;
(5)①实验室制取CO2的化学反应方程式为CaCO3+2HCl═CaCl2+H2O+CO2↑;
②装置H、K中溶液变浑浊,I中溶液不变浑浊,则原石灰水未变浑浊的原因是:二氧化碳中含有氯化氢气体;
③装置I的作用是:证明氯化氢气体已被除尽。

 名师点拨卷系列答案
名师点拨卷系列答案 英才计划期末调研系列答案
英才计划期末调研系列答案【题目】用煤直接做燃料如果不进行处理,会因煤中的硫生成SO2气体造成大气污染。常用两种方法治污,其一在煤中混入粉末状的石灰石,则燃烧产生的SO2会与CaCO3反应生成CaSO3进入炉渣而减少大气污染。其二向燃烧后的烟气喷洒石灰浆也可吸收SO2生成CaSO3。
(1)现用10000元分别购买两种原料来除去SO2,相关数据如下表:
方法 | 物质 | 相对分子质量 | 纯度 | 价格(元/t) | 除SO2的量/t |
A | 石灰石 | 100 | 90% | 200 | 0.288 |
B | 熟石灰 | 74 | 94% | 500 | 0.73 |
工业上多数采用方法B除SO2.其原因有两个分别是:_____;_____。
(2)取50g此炉渣(含24% CaSO3)逐滴加入20%的盐酸,请求出氯化钙和盐酸的相关数据,并在坐标图中画出相应的曲线图(纵坐标为氯化钙的质量,横坐标为盐酸的质量,标出曲线中必要的数据)。_____。
已知:①设炉渣已不含石灰石,炉渣其它成分不与盐酸反应;
②CaSO3和盐酸反应类似于CaCO3。