题目内容
【题目】实验室中有一瓶长期使用的氢氧化钠固体样品,某兴趣小组的同学对该样品的成分及含量进行探究
[发现问题]该样品中含有哪些物质?
[查阅资料]①NaOH在空气中不会转化成NaHCO3②BaCl2溶液呈中性,Ba(OH)2是可溶性碱③CO2在饱和的NaHCO3溶液中几乎不溶解
[提出猜想]猜想Ⅰ:NaOH
猜想Ⅱ:Na2CO3
猜想Ⅲ:NaOH和Na2CO3
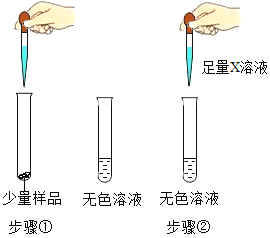
[设计实验]
实验操作 | 实验现象 |
| 步骤(1):样品全部溶解 步骤(2):观察到现象A |
[收集证据](1)若现象A是有气泡产生,则x为_______溶液 (填化学式),则_______(填“猜想Ⅰ”、“猜想Ⅱ” 或“猜想Ⅲ”)不成立。
(2)若X溶液为Ba(OH)2溶液,现象A是有白色沉淀生成,则产生沉淀的化学方程式是______。取反应后的上层清液,测定其pH>7,则证明猜想Ⅲ成立,这个结论是否正确_______(填“是”或“否”)。
[定量分析]确定部分变质样品中Na2CO3的质量分数,兴趣小组的同学用如图所示装置进行实验。
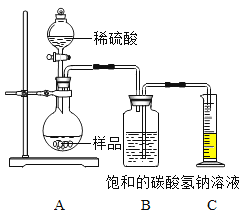
步骤如下:①按图连接好装置,井检查气密性:②准确称取该样品1.0g放入烧瓶内;③打开活塞,滴加30.0%的稀硫酸至过量,关闭活塞;④反应结束后,量筒内液体的读数为55.0mL.(已知:室温条件下,CO2的密度为1.6g﹒L-1 )
(1)B装置集气瓶内原有的空气对实验结果_______(填 “有”或“没有”)影响。B中饱和NaHCO3溶液如果用水代替,则所测CO2体积______(填 “偏大”、“偏小”或“不变”)。
(2)通过计算,便可测得该样品中Na2CO3的质量分数。______
【答案】![]() 猜想Ⅰ
猜想Ⅰ ![]() 否 没有 偏小 21.2%
否 没有 偏小 21.2%
【解析】
二氧化碳和氢氧化钠反应生成碳酸钠和水,碳酸钠和盐酸反应生成氯化钠、水和二氧化碳,氯化钡和碳酸钠会生成碳酸钡沉淀和氯化钠,二氧化碳会与水反应,易溶于水。
[收集证据](1)碳酸钠和盐酸反应生成氯化钠、水和二氧化碳,若现象A是有气泡产生,则x为盐酸溶液,化学式为![]() ,则猜想Ⅰ不成立。
,则猜想Ⅰ不成立。
(2)若X溶液为Ba(OH)2溶液,产生沉淀的反应是碳酸钠和氢氧化钡生成碳酸钡和氢氧化钠,反应的化学方程式是![]() 。碳酸钠和氢氧化钡生成氢氧化钠,显碱性,不能确定是原氢氧化钠还是生成的氢氧化钠,故这个结论不正确。
。碳酸钠和氢氧化钡生成氢氧化钠,显碱性,不能确定是原氢氧化钠还是生成的氢氧化钠,故这个结论不正确。
(1)空气中含有的二氧化碳量很少,不会对实验产生影响,故B装置集气瓶内原有的空气对实验结果没有影响,二氧化碳会与水反应,会使所测CO2体积偏小,会使计算样品中Na2CO3的质量分数的结果偏小,故B中饱和NaHCO3溶液如果用水代替,则所测CO2体积偏小。
(2)设参加反应的碳酸钠的质量为x
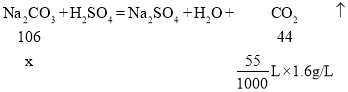
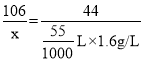
![]()
故该样品中Na2CO3的质量分数为![]()

 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案