题目内容
【题目】如图为甲乙两物质的溶解度曲线,下列说法正确的是( )
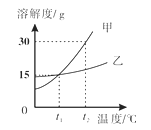
A. 甲物质的溶解度大于乙物质的溶解度
B. t2℃时,甲饱和溶液中溶质的质量分数为30%
C. t2℃时甲、乙饱和溶液降温至t1℃时,甲乙溶液的质量分数相同
D. t1℃时,将10克甲物质放入50克水中,得到溶液的质量为60克
【答案】C
【解析】
溶解度是在一定温度下,某固态物质在100g溶剂中达到饱和状态时所溶解的溶质的质量。
A、比较溶解度时必须限制溶液的温度,否则不能进行比较,故A不正确;
B、t2℃时,甲饱和溶液中溶质的质量分数为![]() ,故B不正确;
,故B不正确;
C、t2℃时,甲、乙饱和溶液降温至t1℃时,甲晶体析出较多,乙有小部分晶体析出,则t1℃时甲乙溶液的质量分数相同,故C正确;
D、t1℃时,甲物质的溶解度为15g,将10克甲物质放入50克水中,溶解的甲物质为
![]() ,则得到溶液的质量为
,则得到溶液的质量为![]() ,故D不正确。故选C。
,故D不正确。故选C。

 红果子三级测试卷系列答案
红果子三级测试卷系列答案 课堂练加测系列答案
课堂练加测系列答案 轻松课堂单元测试AB卷系列答案
轻松课堂单元测试AB卷系列答案【题目】某化学学习小组在老师的指导下,对白色粉笔的成分进行探究。
(提出问题)白色粉笔的主要成分是什么呢?老师提示是一种常见的钙盐与少量性质稳定的粘合剂制成的。
(猜想与假设)同学分别做出如下猜想:
A 碳酸钙 B 氢氧化钙 C 硫酸钙 D 氯化钙 E 硝酸钙
同学们根据老师提示并讨论,立即否定了B的猜想,你认为理由是________.
(查阅资料)
(1)硫酸钙是自然界中石膏矿的主要成分,为白色固体,微溶于水.
(2)室温下几种物质的溶解度
物质 | 碳酸钙 | 氯化钙 | 硫酸钙 | 硝酸钙 |
溶解度/g | 0.0013 | 74.5 | 0.3 | 138 |
(进行实验)
实验操作 | 现象 | 结论 | |
① | 取少量白色粉笔研碎于试管中,加入________ | 无现象 | A不成立 |
② | 取少量白色粉笔研碎于烧杯中,加入少量水,搅拌 | 固体没有明显减少 | ________不成立 |
③ | 将②进行________操作,得到清液A和固体,向清液中加入 ____________溶液,再加入足量稀盐酸 | 产生白色沉淀,沉淀不消失 | C成立 |
请写出③中发生反应的化学方程式___________.
(拓展延伸)为了测定生石膏的组成(CaSO4·xH2O),即测定x的值,做了如下实验:将含结晶水的硫酸钙放在坩埚中加热,加热前和加热后都进行称量.随着实验次数的增加,加热的时间不断延长,他们在实验中将数据整理如下,并利用数据绘制的图象如图所示。
查阅资料:含结晶水的硫酸钙有两种组成形式,在加热过程中,分步失去结晶水,最终得到硫酸钙固体。
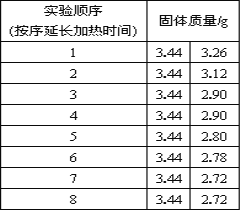

(1)AB段固体质量不变的原因__________。
(2)利用实验数据,计算x= ________.
(3)图中CD段固体物质的化学式 _____________.
【题目】为探究盐酸的化学性质,某化学小组做了如下实验:
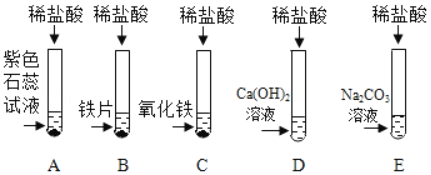
(1)A试管中的实验现象为_____,C试管中所发生反应的化学方程式为_____。
(2)将反应后D、E试管中的废液倒入一个洁净的烧杯中,观察到烧杯中先有气泡产生,后有白色沉淀出现。将烧杯中的混合物过滤,得到白色沉淀和无色滤液。同学们对滤液中溶质的成分进行探究。
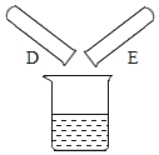
(提出问题)滤液中溶质的成分是什么?
(作出猜想)猜想:NaCl
猜想二:NaCl和CaCl2
猜想三:_____
猜想四:NaCl、Ca(OH)2和HCl
(进行讨论)经过讨论,同学们一致认为猜想_____是错误的。
(设计实验)请完成实验报告。
实验步骤 | 实验现象 | 实验结论 |
取少量滤液于试管中,滴加适量的碳酸钠溶液。 | _____ | 猜想二不成立 |
取少量滤液于试管中,滴加_____(填名称)。 | _____ | 猜想三成立 |
(迁移拓展)稀盐酸、稀硫酸有一些相似的化学性质,是因为在不同的酸溶液中都含有_____。
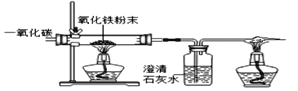
【题目】在高温下,铁与水蒸气能发生反应生成一种常见的铁的氧化物和一种气体.某兴趣小组请你参与研究:铁与水蒸气反应一段时间后剩余固体物质的成分、性质及再利用.
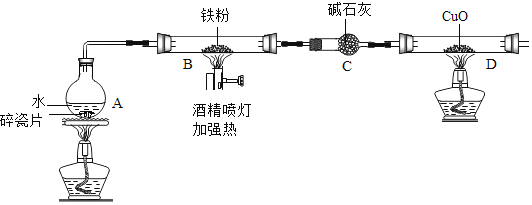
(1)(推断)观察到D中黑色固体变红,则B中生成的气体是______.
(2)探究B装置中剩余固体成分是什么?
(查阅资料)
(1)碎瓦片能防爆沸,碱石灰是氧化钙和氢氧化钠的混合物
(2)铁的氧化物中,只有Fe2O3是红棕色,其余均为黑色,只有Fe3O4能被磁铁吸引.
(3)Fe3O4+8HCl=FeCl2+2FeCl3+4H2O、Fe3O4+4H2SO4=FeSO4+Fe2(SO4)3+4H2O
(初步探究)B装置中剩余固体为黑色,能全部被磁铁吸引
(猜想与假设)
猜想一:剩余固体是Fe3O4
猜想二:剩余固体是______
(实验探究)
实验操作 | 实验现象及结论 |
______ | ______ |
(实验结论)铁与水蒸气反应的化学方程式为______.