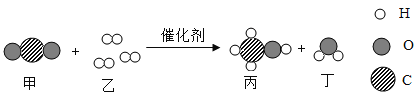
题目内容
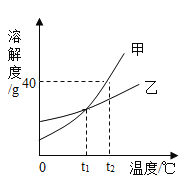
【题目】下图是甲、乙两种固体物质在水中的溶解度曲线,下列说法错误的是( )
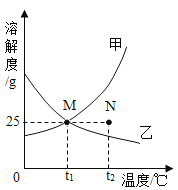
A.甲物质的溶解度随温度的升高而增大
B.将t1℃时的甲、乙两物质的饱和溶液降温到0℃,甲溶液仍为饱和溶液
C.在t2℃时,N点表示甲物质的不饱和溶液,乙物质的饱和溶液,而且两溶液的溶质质量分数相等
D.在t1℃时,100g乙物质的溶液中溶质的质量一定小于25g
【答案】C
【解析】
A、甲物质的溶解度曲线呈上升趋势,所以溶解度随温度的升高而增大,故A正确;
B、将t1℃时的甲、乙两物质的饱和溶液降温到0℃,甲物质的溶解度随温度的降低而减小,会有晶体析出,所以甲溶液仍为饱和溶液,故B正确;
C、在t2℃时,N点表示甲物质的不饱和溶液,乙物质的过饱和溶液,甲溶液的质量分数为![]() ×100%=20%,乙物质的质量分数小于20%,所以甲物质的溶质质量分数大于乙,故C错误;
×100%=20%,乙物质的质量分数小于20%,所以甲物质的溶质质量分数大于乙,故C错误;
D、在t1℃时,乙物质的溶解度是25g,所以125g乙物质的饱和溶液含有乙物质25g,所以100g乙物质的液中溶质的质量一定小于25g,故D正确。
故选:C。

【题目】如图是某实验小组的几位同学设计的“测定空气中氧气含量”的实验装置图,请结合图示回答下列问题:
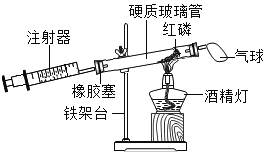
(1)根据下表提供的实验数据,完成下表:
玻璃管中空 气的体积 | 反应前注射器 中空气的体积 | 反应后注射器 中气体的体积 | 实验测得空气中 氧气的体积分数 |
25.0mL | 15.0mL | 7.0mL | ______ |
(2)玻璃管中发生反应的现象是______。
(3)装置中气球的作用是______。
(4)实际实验时测得氧气含量偏小,可能的原因有______、______(列举两条)。
(5)你认为该装置的优点有______(写一条即可)。
【题目】实验室中有一瓶长期使用的氢氧化钠固体样品,某兴趣小组的同学对该样品的成分及含量进行探究
[发现问题]该样品中含有哪些物质?
[查阅资料]①NaOH在空气中不会转化成NaHCO3②BaCl2溶液呈中性,Ba(OH)2是可溶性碱③CO2在饱和的NaHCO3溶液中几乎不溶解
[提出猜想]猜想Ⅰ:NaOH
猜想Ⅱ:Na2CO3
猜想Ⅲ:NaOH和Na2CO3
[设计实验]
实验操作 | 实验现象 |
| 步骤(1):样品全部溶解 步骤(2):观察到现象A |
[收集证据](1)若现象A是有气泡产生,则x为_______溶液 (填化学式),则_______(填“猜想Ⅰ”、“猜想Ⅱ” 或“猜想Ⅲ”)不成立。
(2)若X溶液为Ba(OH)2溶液,现象A是有白色沉淀生成,则产生沉淀的化学方程式是______。取反应后的上层清液,测定其pH>7,则证明猜想Ⅲ成立,这个结论是否正确_______(填“是”或“否”)。
[定量分析]确定部分变质样品中Na2CO3的质量分数,兴趣小组的同学用如图所示装置进行实验。
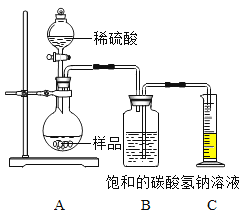
步骤如下:①按图连接好装置,井检查气密性:②准确称取该样品1.0g放入烧瓶内;③打开活塞,滴加30.0%的稀硫酸至过量,关闭活塞;④反应结束后,量筒内液体的读数为55.0mL.(已知:室温条件下,CO2的密度为1.6g﹒L-1 )
(1)B装置集气瓶内原有的空气对实验结果_______(填 “有”或“没有”)影响。B中饱和NaHCO3溶液如果用水代替,则所测CO2体积______(填 “偏大”、“偏小”或“不变”)。
(2)通过计算,便可测得该样品中Na2CO3的质量分数。______