题目内容
【题目】下图是初中化学常见的实验。
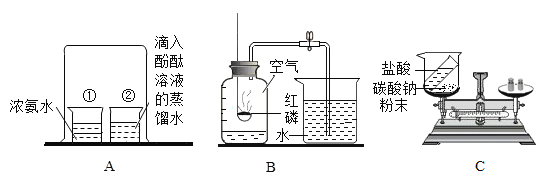
(1)A 实验烧杯于中溶液变红。由此可以得出分子的什么性质_____?
(2)B 实验完毕后,从烧杯中进入集气瓶内水的体积明显小于瓶内原空气体积的1/5 请解释可能存在的原因_____。(写出一种即可)
(3)用 C 实验验证质量守恒定律时,请说明反应后天平不平衡的原因_____。
【答案】分子在不断地运动 红磷量不足(或没有冷却到室温就打开止水夹或装置漏气) 稀盐酸和碳酸钠粉末反应生成的二氧化碳,逸散到空气中了
【解析】
(1)酚酞遇氨水会变红。烧杯①中的氨水中的氨分子不断运动至②烧杯,氨分子接触②烧杯中的水,形成氨水,从而使酚酞变红。从该过程中可以分析出,分子在不断运动。故答案为:分子在不断运动;
(2)B实验结束后,回流的水的体积小于1/5,则可能是红磷不足,没有将氧气完全消耗。或有可能是外界的空气将被消耗的氧气补充回来了,即装置漏气。或内部的空气将消耗的氧气补充了,即未冷却到室温就打开弹簧夹。故答案为:红磷量不足(或没有冷却到室温就打开止水夹或装置漏气);
(3)稀盐酸和碳酸钠反应生成氯化钠、水和二氧化碳。而二氧化碳是一种气体,反应后会逸散到空气中,所以天平不平衡。故答案为:稀盐酸和碳酸钠粉末反应生成的二氧化碳,逸散到空气中了。

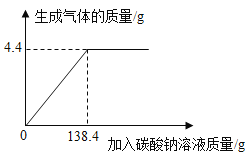
【题目】为测定某样品(碳酸钠和氯化钠的混合物)中碳酸钠的质量分数,某化学兴趣小组进行以下实验,取50g的样品放置于烧杯中,然后取一定溶质质量分数的稀盐酸200g,分四等分,每次向装样品的烧杯中加入50g,实验测得加入稀盐酸的质量与反应后烧杯中物质的总质量的关系如下表。(▲是该化学兴趣小组未测量的质量)
加入稀盐酸的质量/g | 50 | 100 | 150 | 200 |
反应后烧杯中物质的总质量/g | 91.2 | 132.4 | 182.4 | ▲ |
Ⅰ.该小组同学小明认为▲数据无需测量即可求得样品中碳酸钠的质量分数,请说明理由:__________________。
Ⅱ.计算
(1)样品中碳酸钠的质量分数_______
(2)所用稀盐酸的溶质质量分数_______