题目内容
【题目】探究水蒸气通过灼热的木炭后,得到的混合气体的主要成分。
【提出猜想】该混合气体主要成分为CO、CO2、H2和H2O。
【查阅资料】a.浓硫酸可作干燥剂。b.氢气在加热的条件下与氧化铜反应生成铜和水。
【实验过程】设计实验装置如下:(部分夹持仪器已略去;假设每个装置里的药品足量,反应充分)。
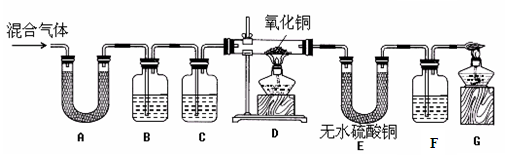
①装置A中无水硫酸铜变蓝,写出该反应的化学方程式 (11) ,装置B中澄清石灰水变浑浊,写出该反应的化学方程式 (12) ,由此得出混合气体中含有CO2和H2O气体;
②通过观察装置D、E中的现象后,为了确认混合气体中含有氢气,装置C中的试剂是 (13) 。为了证明CO气体的存在,装置F中试剂是 (14) 。
【实验结论】猜想正确。
【答案】(11)CuSO4+5H2O===CuSO45H2O (12) CO2+Ca(OH)2→CaCO3↓+H2O
(13) 浓硫酸 (14)澄清石灰水
【解析】
试题分析:(11)无水硫酸铜与水反应,得到蓝色的硫酸铜,化学方程式为:CuSO4+5H2O====CuSO45H2O;(12)二氧化碳与澄清的石灰水反应,得到碳酸钙和水,反应的化学方程式为:CO2 + Ca(OH)2 = CaCO3↓+ H2O;(13)装置C中的试剂为浓硫酸,吸收气体中的水分,排除对混合气体中氢气存在的干扰;如果混合气体中含有一氧化碳,则一氧化碳会与氧化铜反应,生成二氧化碳,所以装置F中盛放的是石灰水,如果石灰水变浑浊,则证明混合气体中含有一氧化碳。

练习册系列答案
相关题目