题目内容
【题目】
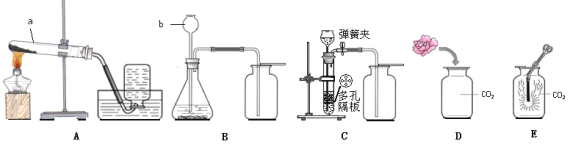
根据下图回答问题。
①仪器名称:a (10) 、b (11) 。
②实验室用大理石和稀盐酸制取二氧化碳,选用装置C优于B的原因是 (12) ;收集一瓶二氧化碳,将燃着的木条放在瓶口,若观察到 (13) ,说明已集满。
③取一朵用紫色石蕊试液染成紫色的干燥小花,将小花的一半用水喷湿,放入装置D中,观察到的实验现象是 (14) ,此现象说明CO2具有的化学性是 (15) (用化学方程式表示)。
④装置E中镁条能在CO2中剧烈燃烧,发出白光,放热,产生白色固体和黑色固体,反应的化学方程式
是 (16) 。
⑤欲测定鸡蛋壳中碳酸钙的质量分数。取12.5g干燥的碎鸡蛋壳放入烧杯中,向其中加入40g稀盐酸恰好完全反应(假设鸡蛋壳中除碳酸钙外其他成分均不与稀盐酸反应产生气体),反应后烧杯中物质的总质量为48.1g。计算:
Ⅰ.反应产生二氧化碳的质量为 (17) g;
Ⅱ.鸡蛋壳中碳酸钙的质量分数 (18) (通过化学方程式列式计算)。
【答案】①试管 长颈漏斗 ②能够随时控制反应的发生与停止; 燃烧的木条熄灭
③小花被水喷湿的部分紫色石蕊变红色,干燥处没有变红色;![]()
④![]()
⑤Ⅰ.4.4 80.0%
【解析】
试题分析:实验室用大理石和稀盐酸制取二氧化碳,选用装置C优于B的原因是能够随时控制反应的发生与停止;验满是要将燃着的木条放在瓶口处如果燃烧的木条熄灭,说明满了。③小花被水喷湿的部分紫色石蕊变红色,干燥处没有变红色;因为发生了如下的反应:![]()
④![]() ; 反应产生二氧化碳的质量=12.5克+40克-48.1克=4.4克,
; 反应产生二氧化碳的质量=12.5克+40克-48.1克=4.4克,
解:设待测液中有碳酸钙x mol
![]()
1 1
x 0.1
1:x=1:0.1 x=0.1 (mol)
CaCO3%=0.1×100/12.5 =80.0% 答:鸡蛋壳中碳酸钙的质量分数为80.0%