题目内容
【题目】铁是目前使用最广泛的金属。
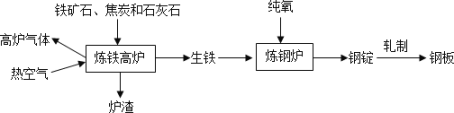
(一)工业上炼铁炼钢和轧制钢材的主要流程如图。
(1)高炉炼铁中生成一氧化碳的反应,用化学方程式表示:______。
(2)炼铁的固体原料需经过粉碎,其目的是______。
(3)热空气和高炉气体的主要成分有一种相同,这种气体的化学式是______。
(4)炼钢炉中,通入纯氧的目的是______。将钢锭轧成钢板,体现了金属的______性。
(二)工业铁红的主要成分是Fe2O3,还含有少量的FeO、Fe3O4.为了测定铁红中的质量分数,某兴趣小组进行了如下实验。
(查阅资料)
①草酸(H2C2O4)固体与浓硫酸混合加热会产生一氧化碳,化学反应方程式为H2C2O4![]() CO↑+CO2↑+H2O
CO↑+CO2↑+H2O
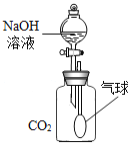
②NaOH溶液可以吸收二氧化碳。
③浓硫酸具有强烈的吸水性,可以除去气体中的水分。
④碱石灰可以吸收二氧化碳和水。
⑤氧化亚铁、氧化铁、四氧化三铁中铁的质量分数分别为77.8%、70%和72.4%。
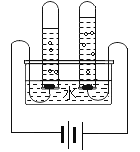
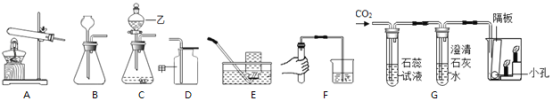
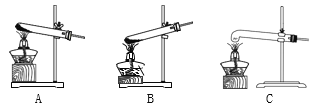
(5)加热分解草酸晶体最.适.宜.的装置是________(填字母序号)。
(问题讨论)用下图所示装置进行实验:
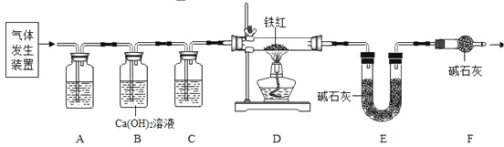
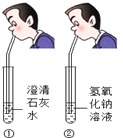
(6)实验前应先______
(7)进入D中的气体是纯净干燥的CO,则A、C中的试剂依次是________(填字母编号)a.浓硫酸b.澄清的石灰水c.氢氧化钠溶液
(8)B装置的作用是________
(9)对D装置加热前和停止加热后,都要通入过量的CO,其作用分别是:①加热前____②停止加热后______
(10)写出D装置中主.要.发生反应的化学方程式________
(数据分析与计算)
(11)称取铁红样品10.0g,用上述装置进行实验,测定铁红中铁的质量分数.
①D中充分反应后得到Fe粉的质量为mg,则________<m<________(结果保留到0.1)
②实验前后称得E装置增重6.6g,则此铁红中铁的质量分数是___。
(实验评价)
(12)反思1:本实验如果缺少C装置(不考虑其它因素),则测得样品中铁的质量分数会________(填“偏小”、“不变”或“偏大”)。
反思2:请指出(问题讨论)中实验装置的一个明显缺陷______。
【答案】CO2+C![]() 2CO 增大反应物的接触面积 N2 使生铁中的碳转化为二氧化碳,降低生铁中的含碳量 延展性 A 检查装置的气密性 ca 检验是否除尽二氧化碳 排净玻璃管内的空气,防止发生爆炸 使生成的二氧化碳全部被碱石灰吸收 Fe2O3+3CO
2CO 增大反应物的接触面积 N2 使生铁中的碳转化为二氧化碳,降低生铁中的含碳量 延展性 A 检查装置的气密性 ca 检验是否除尽二氧化碳 排净玻璃管内的空气,防止发生爆炸 使生成的二氧化碳全部被碱石灰吸收 Fe2O3+3CO![]() 2Fe+3CO2 7.0 7.8 76% 偏小 缺少尾气处理装置
2Fe+3CO2 7.0 7.8 76% 偏小 缺少尾气处理装置
【解析】
(1)高炉中的一氧化碳是由二氧化碳与碳在高温条件下反应生成的,故反应的化学方程式写为:CO2+C![]() 2CO。
2CO。
(2)炼铁的固体原料需经过粉碎可以增大反应物的接触面积,加快反应速率,故填增大反应物的接触面积。
(3)空气中含量最多的氮气不参加反应,在反应后的高炉气中仍存在,其化学式为N2,故填N2。
(4)炼钢炉中,通入纯氧可以使生铁中的碳转化为二氧化碳,降低生铁中的含碳量,故填使生铁中的碳转化为二氧化碳,降低生铁中的含碳量;
钢锭轧成钢板,增大了钢的表面积,体现了金属的延展性,故填延展性。
(5)加热固体生成气体,应选择固体受热发生装置,故填A。
(6)由气体生成或参加的实验,实验前应检查装置的气密性,防止气体逸散,故填检查装置的气密性。
(7)由图可知,装置A用来吸收二氧化碳,装置C用来干燥气体,所以 A中试剂为氢氧化钠溶液,装置C中的试剂为浓硫酸,故填ca。
(8)由图可知,装置B的作用是检验装置A是否除尽二氧化碳,故填检验是否除尽二氧化碳。
(9)①加热前通入过量的 CO可以排净玻璃管内的空气,防止发生爆炸,故填排净玻璃管内的空气,防止发生爆炸;
②停止加热后通入过量的 CO可以排净装置中的二氧化碳,使其全部被E装置中的碱石灰吸收,故填使生成的二氧化碳全部被碱石灰吸收。
(10)一氧化碳与氧化铁在高温条件下反应生成铁和二氧化碳,故反应的化学方程式写为:Fe2O3+3CO![]() 2Fe+3CO2。
2Fe+3CO2。
(11)①根据质量守恒定律,若铁红中全部是氧化亚铁,则得到的铁的质量为10.0g×77.8%≈7.8g,若全部是氧化铁,则得到的铁的质量是10.0g×70%=7.0g,所以得到铁的质量范围为7.0<m<7.8,故填7.0、7.8;
②E 装置增重 6.6g,则生成二氧化碳的质量为6.6g,其中氧元素的质量为6.6g×![]() ×100%=4.8g,铁红中氧元素的质量为2.4g,则铁红中铁的质量分数为
×100%=4.8g,铁红中氧元素的质量为2.4g,则铁红中铁的质量分数为![]() ×100%=76%故填76%。
×100%=76%故填76%。
(12)如果缺少 C 装置,水蒸气会进入E装置,碱石灰具有吸水性,因此E装置会增重,求得氧元素的质量偏大,则求得铁元素的质量分数会偏小,故填偏小;
尾气中含有一氧化碳,没有尾气处理装置直接排放会污染空气,故填缺少尾气处理装置。