题目内容
【题目】初中化学中,我们学习了酸和碱发生中和反应的实质是H++OH-===H2O。如图,像这种用实际参加反应的离子符号表示反应的式子叫离子方程式。离子方程式的书写一般步骤如下:(以碳酸钠与氯化钙反应为例)
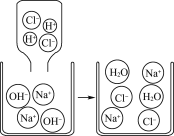
Ⅰ.写出反应的化学方程式_________________________。
Ⅱ.把易溶于水、易电离的物质写成离子形式,把难溶的物质、气体和水等仍用化学式表示。上述方程式可改写成2Na++![]() +Ca2++2Cl-===CaCO3↓+2Na++2Cl-
+Ca2++2Cl-===CaCO3↓+2Na++2Cl-
Ⅲ.删除方程式两边不参加反应的离子Ca2++![]() ===CaCO3↓
===CaCO3↓
Ⅳ.检查方程式两边各元素的原子个数和电荷数是否相等。
试回答:
(1)酸、碱、盐在水溶液中发生的复分解反应实质就是两种化合物在溶液中相互交换离子的反应,只要具备生成物中有气体或水或____________生成,反应就能发生。
(2)写出稀盐酸滴在大理石上所发生反应的离子方程式_____________________。
(3)用pH试纸测量稀盐酸的酸碱度时,先用水湿润试纸,则测得的结果将________(填“偏大”“偏小”或“无影响”)。
(4)下列各组离子,能在溶液中大量共存的是______。
A.Na+、H+、![]() 、OH- B.Na+、Ca2+、
、OH- B.Na+、Ca2+、![]() 、Cl-
、Cl-
C.Na+、H+、![]() 、Cl- D.K+、Cu2+、
、Cl- D.K+、Cu2+、![]() 、Cl-
、Cl-
(5)写出一个能用Fe+2H+===Fe2++H2↑表示的化学方程式________________________。
【答案】Na2CO3+CaCl2=CaCO3↓+2NaCl 沉淀 2H++CaCO3=Ca2++H2O+CO2↑ 偏大 D Fe+2HCl=FeCl2+H2↑(或Fe+H2SO4=FeSO4+H2↑)
【解析】
Ⅰ、碳酸钠和氯化钙反应生成碳酸钙的沉淀和氯化钠,反应的化学方程式为:Na2CO3+CaCl2=CaCO3↓+2NaCl;
(1) 酸、碱、盐在水溶液中发生的复分解反应实质就是两种化合物在溶液中相互交换离子的反应,只要具备生成物中有气体或水或沉淀生成,反应就能发生;
(2)石灰石和盐酸反应的离子反应为:CaCO3+2H+=Ca2++H2O+CO2↑;
(3)用pH试纸测量稀盐酸的酸碱度时,先用水湿润试纸,相当于向原稀盐酸中加水进行稀释。故则测得的结果将偏大;
(4)A、H+ 和OH-反应生成水,不能大量共存,选项错误;
B、Ca2+与![]() 反应生成碳酸钙的沉淀,不能大量共存,选项错误;
反应生成碳酸钙的沉淀,不能大量共存,选项错误;
C、H+ 和![]() 反应生成二氧化碳和水,不能大量共存,选项错误;
反应生成二氧化碳和水,不能大量共存,选项错误;
D、这几种离子之间不反应,所以能大量共存,选项正确。故选D;
(5) 与离子方程式Fe+2H+=e2++H2↑相对应的化学方程式:Fe+2HCl=FeCl2+H2↑(或Fe+H2SO4=FeSO4+H2↑)