题目内容
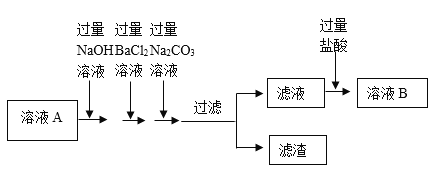
【题目】为了除去某氯化钠样品中含有的可溶性杂质CaCl2、MgCl2、Na2SO4,设计提纯的流程图如图,请认真分析各步的信息作答:
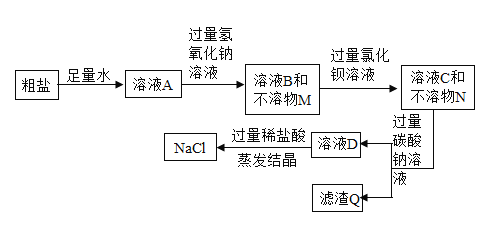
(1)写出用NaOH溶液除去MgCl2的化学方程式_____。
(2)写出不溶物N的成分(用化学方程式表示)_____。
(3)加入过量稀盐酸的目的是什么?_____。
【答案】MgCl2+2NaOH═Mg(OH)2↓+2NaCl BaCl2+Na2SO4═BaSO4↓+2NaCl 除去过量的氢氧化钠、碳酸钠
【解析】
加入过量的氢氧化钠溶液时,氢氧化钠和氯化镁反应生成氢氧化镁沉淀和氯化钠,加入过量的氯化钡溶液时,氯化钡和硫酸钠反应生成硫酸钡沉淀和氯化钠,加入过量的碳酸钠溶液时,碳酸钠和氯化钙反应生成碳酸钙沉淀和氯化钠,和过量的氯化钡反应生成碳酸钡沉淀和氯化钠,加入适量稀盐酸时,稀盐酸和过量的氢氧化钠反应生成氯化钠和水,和过量的的碳酸钠反应生成氯化钠、水和二氧化碳。
(1)氢氧化钠和氯化镁反应生成氢氧化镁沉淀和氯化钠,反应的化学方程式:MgCl2+2NaOH═Mg(OH)2↓+2NaCl;
(2)不溶物N是氯化钡和硫酸钠反应生成的硫酸钡沉淀,反应的化学方程式:BaCl2+Na2SO4═BaSO4↓+2NaCl;
(3)加入过量稀盐酸的目的是除去过量的氢氧化钠、碳酸钠。

 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案【题目】溶液是我们生活中常见的物质,根据所学化学知识分析并回答问题:
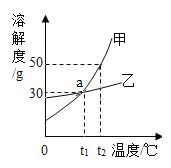
Ⅰ.氯化钠、硝酸钾在不同温度时的溶解度如下表:
温度/℃ | 10 | 20 | 40 | 50 | |
溶解度/g | NaCl | 35.8 | 36.0 | 36.6 | 37.0 |
KNO3 | 20.9 | 31.6 | 63.9 | 85.5 |
从上表可知,两种物质的溶解度受温度变化影响较大的是_____;某温度下它们溶解度相同,则该温 度可能在_____范围内;50℃时,将氯化钠和硝酸钾各 50g 的混合物,加入到 100g 水中,充分搅拌,不能完全溶解的物质是_____,若再冷却到 10℃时,过滤后,所得溶液的质量是_____g
Ⅱ. 若要提纯混有少量氯化钠的硝酸钾饱和溶液,可采用方法是_____
Ⅲ.20℃时,能否配制出 30%硝酸钾溶液,理由是_____