题目内容
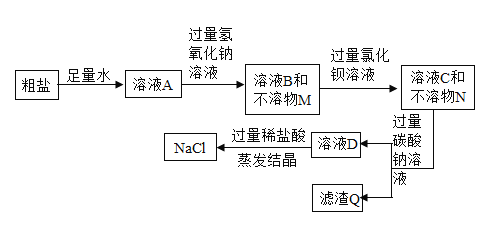
【题目】海水通过晒制可得粗盐,粗盐中除NaCl外,还含有MgCl2、CaCl2、Na2SO4以及泥沙等杂质。以下是实验室模拟粗盐制备精盐的过程。
①步骤一:去除粗盐中的泥沙
I、称取粗盐样品10.0g,用蒸馏水充分溶解;
Ⅱ、过滤去除泥沙得溶液A;
以上两步操作中均需要使用到玻璃棒,过滤时玻璃棒的作用是_____。
②步骤二:去除粗盐中的可溶性杂质
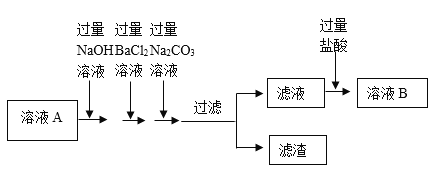
I、加入“过量Na2CO3溶液”时,发生反应的化学方程式_____。
II、理论上用过量的_____溶液(填一种物质)代替NaOH和BaCl2两种溶液,也可以达到相同实验目的。
Ⅲ、为了证明所加的盐酸已过量,某同学取少量溶液B,向其中加入_____(填一种试剂),若产生_____(填实验现象),则证明盐酸已过量。
④步骤三:获得产品
将溶液B注入_____(填仪器名称)中,在不断搅拌下加热,观察到_____,停止加热,利用余热蒸干。最终得到精盐9.4g。
④步骤四:数据处理
该粗盐样品中,氯化钠的质量分数为94%。
[结果与反思]实验操作、试剂和装置均不存在问题,老师却指出该样品中氯化钠的质量分数不是94%,原因是_____。
【答案】引流 ![]() 、
、![]() 氢氧化钡 紫色石蕊试液(合理即可) 溶液变红 蒸发皿 蒸发皿中出现较多固体时 粗盐精制过程中,反应生成了氯化钠
氢氧化钡 紫色石蕊试液(合理即可) 溶液变红 蒸发皿 蒸发皿中出现较多固体时 粗盐精制过程中,反应生成了氯化钠
【解析】
①过滤时,玻璃棒的作用是:引流;
②Ⅰ、粗盐中除NaCl外,还含有MgCl2、CaCl2、Na2SO4,加入过量氢氧化钠,氢氧化钠与氯化镁反应生成氢氧化镁和氯化钠,除去氯化镁,加入过量氯化钡,氯化钡与硫酸钠反应生成硫酸钡和氯化钠,除去硫酸钠,加入过量碳酸钠,碳酸钠与氯化钙反应生成碳酸钙和氯化钠,该反应的化学方程式为:![]() ,碳酸钠与过量的氯化钡反应生成碳酸钡和氯化钠,该反应的化学方程式为:
,碳酸钠与过量的氯化钡反应生成碳酸钡和氯化钠,该反应的化学方程式为:![]() ,故填:
,故填:![]() 、
、![]() ;
;
Ⅱ、氢氧化钡能与氯化镁反应生成氢氧化镁和氯化钡,氢氧化钡能与硫酸钠反应生成硫酸钡和氢氧化钠,然后用碳酸钠除去氢氧化钡和氯化钡,故理论上用过量的氢氧化钡溶液代替NaOH和BaCl2两种溶液,也可以达到相同实验目的;
Ⅲ、盐酸呈酸性,若盐酸过量,则溶液呈酸性,紫色石蕊试液在酸性溶液中变红,故可加入紫色石蕊试液,若溶液变红,则盐酸过量(方案合理即可);
④溶液B为氯化钠溶液(含过量盐酸),可将溶液B注入蒸发皿中,在不断搅拌下加热,使氯化氢和水分挥发除去,观察到蒸发皿中出现较多固体时,停止加热,故填:蒸发皿、蒸发皿中出现较多固体时;
结果与反思:粗盐精制过程中,反应生成了氯化钠,故该样品中氯化钠的质量分数不是94%,应小于94%,故填:粗盐精制过程中,反应生成了氯化钠。