题目内容
【题目】常温下,过氧化氢分解生成氧气的速率较为缓慢。研究性学习小组选择“过氧化氢分解生成氧气的快慢与什么因素有关”的课题进行探究,以下是他们探究的主要过程:
[假设] 催化剂的种类会影响过氧化氢分解生成氧气的快慢。
[查阅资料] 二氧化锰和氯化钠等可以加快过氧化氢分解生成氧气的速率。
[实验方案] 常温下,取两份同体积、同浓度的过氧化氢溶液,分别加入二氧化锰和氯化钠固体,测量各生成一瓶相同体积的氧气所需的时间。
[实验装置] 如下图是他们进行实验的装置图:
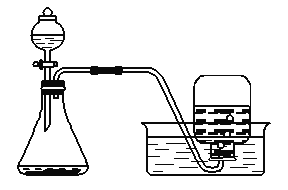
[实验操作] 检查装置气密性良好,将分液漏斗中的液体加入锥形瓶中,立即收集一瓶放出的气体。实验记录如下表:
实验编号 | ① | ② |
反应物 | 5%过氧化氢溶液100 mL | 5%过氧化氢溶液100 mL |
加入固体 | 氯化钠固体 | 0.5 g二氧化锰 |
收集气体 所需时间 | 165 s | 46 s |
写出实验①中反应的文字表达式____________。实验①中加入氯化钠固体的质量是________g。
[结论] 该探究过程得出的结论是________________。
[反思] 若要证明二氧化锰、氯化钠固体是该反应的催化剂,还需要增加实验来验证它们在化学反应前后的______和_______是否改变。催化剂的作用是_________。
[交流讨论] 某同学提出,过氧化氢分解生成氧气的快慢还与哪些因素有关?请你帮助他们继续探究(提出一种影响过氧化氢分解生成氧气快慢的因素以及相关假设,并设计实验方案)。
[你的假设] ___________。
[设计方案]
实验方法及步骤 | 可能观察到 的实验现象 | 实验结论 |
________ | __________ | 假设正确 |
【答案】过氧化氢![]() 水+氧气 0.5 不同种类的催化剂对过氧化氢的分解速率影响不同(其他合理答案均可) 化学性质 质量 催化作用 过氧化氢溶液的浓度大小对分解速率有影响 取相同体积、浓度不同的过氧化氢溶液,加入相同质量的同种催化剂,比较产生氧气的快慢 浓度大的产生氧气的速率快
水+氧气 0.5 不同种类的催化剂对过氧化氢的分解速率影响不同(其他合理答案均可) 化学性质 质量 催化作用 过氧化氢溶液的浓度大小对分解速率有影响 取相同体积、浓度不同的过氧化氢溶液,加入相同质量的同种催化剂,比较产生氧气的快慢 浓度大的产生氧气的速率快
【解析】
实验操作:实验①为过氧化氢分解制取氧气,故反应的文字表达式为过氧化氢![]() 水+氧气,实验②中加入二氧化锰的质量为0.5g,故加入氯化钠的质量也为0.5g;
水+氧气,实验②中加入二氧化锰的质量为0.5g,故加入氯化钠的质量也为0.5g;
结论:根据表格中的数据可知,加入氯化钠和二氧化锰后,两个实验过氧化氢分解速率不同,故该探究过程得出的结论是不同种类的催化剂对过氧化氢的分解速率影响不同;
反思:催化剂在化学反应前后质量和化学性质均不变,故若要证明二氧化锰、氯化钠固体是该反应的催化剂,还需要增加实验来验证它们在化学反应前后的质量和化学性质是否改变;催化剂作用是改变化学反应速率,起催化作用;
你的假设:影响过氧化氢分解生成氧气快慢的因素除了催化剂种类,还可能与过氧化氢溶液的浓度大小有关,故假设为过氧化氢溶液的浓度大小对分解速率有影响;
设计方案:
实验方法及步骤:取相同体积、浓度不同的过氧化氢溶液,加入相同质量的同种催化剂,比较产生氧气的快慢;
实验现象:浓度大的产生氧气的速率快。

 智慧课堂密卷100分单元过关检测系列答案
智慧课堂密卷100分单元过关检测系列答案 单元期中期末卷系列答案
单元期中期末卷系列答案【题目】为了检测石灰石样品中碳酸钙的含量,甲、乙、丙、丁四位同学分别用质量分数相同的盐酸与样品充分反应进行实验测定。已知,样品中的杂质不溶于水,且不与盐酸反应。测得数据如下表:
甲 | 乙 | 丙 | 丁 | |
所取石灰石样品质量/g | 10.0 | 10.0 | 10.0 | 10.0 |
加入盐酸的质量/g | 20.0 | 30.0 | 45.0 | 50.0 |
剩余固体的质量/g | 6.0 | 4.0 | 2.0 | 2.0 |
请回答:
⑴ 样品中碳酸钙的质量分数是_______;
⑵10.0 g样品与45.0 g盐酸充分反应后,盐酸是否还有剩余_______(填“是”或“否”);
⑶10.0 g样品与足量稀盐酸反应后可产生二氧化碳_____克?(写出计算过程,计算结果精确到0.1 g)
(可能用到的相对原子质量:H—1 C—12 O—16 Cl—35.5 Ca—40)