题目内容
【题目】写出有关化学反应的符号表达式及其所属的基本反应类型。
(1)硫在氧气中燃烧:______________ (__________)
(2)氯酸钾和二氧化锰混合加热制氧气:___________ (__________)
(3)磷在空气中燃烧:______________(__________)
【答案】S+O2![]() SO2 化合反应; KClO3
SO2 化合反应; KClO3![]() KCl+O2 分解反应; P+O2
KCl+O2 分解反应; P+O2 ![]() P2O5 化合反应。
P2O5 化合反应。
【解析】
由两种或两种以上物质生成一种物质的反应叫化合反应;由一种物质生成两种或两种以上物质的反应叫分解反应;符号表达式的书写方法:在箭头的左边写出反应物的符号,在箭头的右边写出生成物的符号,箭头的上方标出反应条件。
(1)硫在氧气中燃烧生成二氧化硫,符号表达式为:S+O2![]() SO2 ,属于化合反应;
SO2 ,属于化合反应;
(2)氯酸钾和二氧化锰混合加热生成氧气、氯化钾,符号表达式为:KClO3![]() KCl+O2,属于分解反应;
KCl+O2,属于分解反应;
(3)磷在空气中燃烧生成五氧化二磷,符号表达式为:P+O2 ![]() P2O5 ,属于化合反应。
P2O5 ,属于化合反应。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】小余阅读课外资料得知:双氧水分解除了用二氧化锰(MnO2)还可用氧化铜(CuO)等物质作催化剂,于是他对氧化铜产生了探究兴趣.
(提出问题)氧化铜是否也能作氯酸钾分解的催化剂?它是否比二氧化锰催化效果更好?
(设计实验)小余以生成等体积的氧气为标准,设计了下列三组实验(其它可能影响实验的因素均忽略)
实验序号 | 氯酸钾质量 | 其他物质质量 | 待测数据 |
① | 1.2g | / | |
② | 1.2g | CuO 0.5g | |
③ | 1.2g | MnO2 0.5g |
①上述实验应测 量的“待测数据”是________________ .
②若实验②比实验①的“待测数据”____________ (填“大”或“小”),说明氧化铜能加快氯酸钾的分解.
③将实验②反应剩余的固体取出后经洗涤、干燥,再次精确称量得到0.5g黑色粉末,这样做的目的是____________,小余同学认为氧化铜肯定是氯酸钾分解的催化剂,但小淳同学对此提出了异议,小淳同学设计了如下实验:将第二次精确称量得到的0.5g黑色粉末和1.2g氯酸钾混合放入试管中,加热,伸入带火星木条,发现木条很快复燃.小淳同学这样做目的是____________;
(预期结论)氧化铜也能作氯酸钾的催化剂.
(评价设计)你认为小余设计实验③和实验②对比的目的是____________; 写出实验②反应的化学方程式________
【题目】在老师的指导下,同学们进行了有趣的化学实验探究:
一、测定空气中氧气含量
图1所示的是小亮同学用红磷在空气中燃烧的测定方法.过程是:
第1步:将集气瓶容积划分为五等份,并做好标记.
第2步:点燃燃烧匙内的红磷,伸入集气瓶中并把塞子塞紧.
第3步:待红磷熄灭并冷却后,打开弹簧夹,发现水被吸入集气瓶中,进入集气瓶中水的体积约为集气瓶总容积的1/5.请回答下列问题:
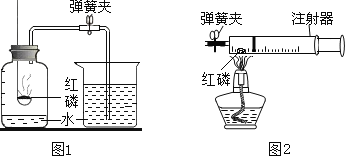
①第2步红磷燃烧时的现象____________________ ,化学反应表达式________________
②实验完毕,若进入集气瓶中水的体积不到总容积的1/5,你认为导致这一结果的原因可能是____________.
A、集气瓶底部的水占了一部分体积
B、红磷过少
C、红磷没有燃烧完就急着打开了止水夹
③小博同学对实验进行反思后,提出了改进方法(如图2所示),小博在正式开始实验前,夹紧弹簧夹,将注射器活塞从20mL刻度处推至15mL处,然后松开活塞,观察到活塞返回至20mL刻度处.该操作的主要目的是____________ ,你认为改进后的优点是____________
二、小余阅读课外资料得知:双氧水分解除了用二氧化锰(MnO2)还可用氧化铜(CuO)等物质作催化剂,于是他对氧化铜产生了探究兴趣.
(提出问题)氧化铜是否也能作氯酸钾分解的催化剂?它是否比二氧化锰催化效果更好?
(设计实验)小余以生成等体积的氧气为标准,设计了下列三组实验(其它可能影响实验的因素均忽略)
实验序号 | 氯酸钾质量 | 其他物质质量 | 待测数据 |
① | 1.2g | / | |
② | 1.2g | CuO 0.5g | |
③ | 1.2g | MnO2 0.5g |
①上述实验应测 量的“待测数据”是____________ .
②若实验②比实验①的“待测数据”____________ (填“大”或“小”),说明氧化铜能加快氯酸钾的分解.
③将实验②反应剩余的固体取出后经洗涤、干燥,再次精确称量得到0.5g黑色粉末,这样做的目的是____________,小余同学认为氧化铜肯定是氯酸钾分解的催化剂,但小淳同学对此提出了异议,小淳同学设计了如下实验:将第二次精确称量得到的0.5g黑色粉末和1.2g氯酸钾混合放入试管中,加热,伸入带火星木条,发现木条很快复燃.小淳同学这样做目的是________ ,
(预期结论)氧化铜也能作氯酸钾的催化剂.
(评价设计)你认为小余设计实验③和实验②对比的目的是________; 写出实验②反应的表达式________
三、有趣的改进实验
①小晴同学学了分子性质这节内容后,改进了书本上 探究分子运动的实验.小晴同学找来废弃的医疗用品--微型Y 形管,设计如图所示实验,
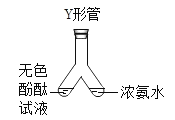
她进行该实验是为了探究____________ ,实验过程中能看到的现象是____________ ,小晴同学设计的实验优点________.
②利用如图装置进行“硫燃烧”的实验:用气卿(能不断鼓入空气的装置)不断地向弯型具支试管中鼓入空气,同时用酒精灯给硫粉加热至燃烧,移去酒精灯,可观察到微弱的淡蓝色火焰;然后停止鼓入空气,再用酒精灯给高锰酸钾加热,使硫在纯氧中继续燃烧,观察到________ 火焰.
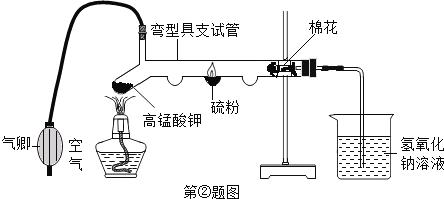
写出实验中硫磺燃烧的化学反应表达式:________.该实验置的主要优点是在消除有害气体对环境污染的前提下有利于________ .你推断烧杯中的氢氧化钠溶液的作用是____________ .
【题目】常温下,过氧化氢分解生成氧气的速率较为缓慢。研究性学习小组选择“过氧化氢分解生成氧气的快慢与什么因素有关”的课题进行探究,以下是他们探究的主要过程:
[假设] 催化剂的种类会影响过氧化氢分解生成氧气的快慢。
[查阅资料] 二氧化锰和氯化钠等可以加快过氧化氢分解生成氧气的速率。
[实验方案] 常温下,取两份同体积、同浓度的过氧化氢溶液,分别加入二氧化锰和氯化钠固体,测量各生成一瓶相同体积的氧气所需的时间。
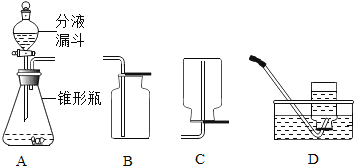
[实验装置] 如下图是他们进行实验的装置图:
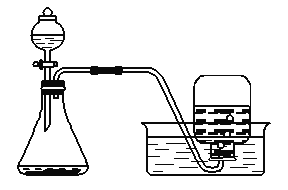
[实验操作] 检查装置气密性良好,将分液漏斗中的液体加入锥形瓶中,立即收集一瓶放出的气体。实验记录如下表:
实验编号 | ① | ② |
反应物 | 5%过氧化氢溶液100 mL | 5%过氧化氢溶液100 mL |
加入固体 | 氯化钠固体 | 0.5 g二氧化锰 |
收集气体 所需时间 | 165 s | 46 s |
写出实验①中反应的文字表达式____________。实验①中加入氯化钠固体的质量是________g。
[结论] 该探究过程得出的结论是________________。
[反思] 若要证明二氧化锰、氯化钠固体是该反应的催化剂,还需要增加实验来验证它们在化学反应前后的______和_______是否改变。催化剂的作用是_________。
[交流讨论] 某同学提出,过氧化氢分解生成氧气的快慢还与哪些因素有关?请你帮助他们继续探究(提出一种影响过氧化氢分解生成氧气快慢的因素以及相关假设,并设计实验方案)。
[你的假设] ___________。
[设计方案]
实验方法及步骤 | 可能观察到 的实验现象 | 实验结论 |
________ | __________ | 假设正确 |