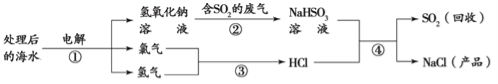
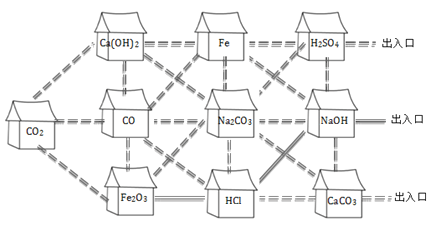
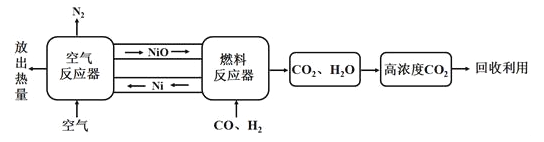
题目内容
【题目】已知A、B、C、D、E是初中化学常见物质且只有D含金属元素。其中E为单质,其余物质为化合物,A为温室气体,C为氧化物。(“﹣”表示物质间能够发生反应,“→”表示物质能够发生转化,部分反应物、生成物以及反应条件已省略)
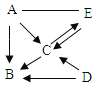
(1)E的化学式为_____。
(2)D转化成B反应的化学方式为_____。
【答案】O2 Cu+CO![]() CuO+CO2
CuO+CO2
【解析】
根据题目分析,A为温室气体,且能和E反应反应,E为单质,可知A为甲烷,E为氧气,两者可发生反应生成二氧化碳和水;氧气和氢气反应生成水,甲烷和氧气反应生成水和二氧化碳,C为水,B为二氧化碳,D中含有金属元素,且反应生成二氧化碳,可知D转化为B为,氧化铜和一氧化碳反应生成铜单质和二氧化碳,代入验证,推理正确。
(1)综上述分析可知E为氧气,其化学式为O2;
(2)D转化为B即氧化铜和一氧化碳反应生成铜单质和二氧化碳,其反应的化学方程式为Cu+CO![]() CuO+CO2。
CuO+CO2。

 桃李文化快乐暑假武汉出版社系列答案
桃李文化快乐暑假武汉出版社系列答案 优秀生快乐假期每一天全新寒假作业本系列答案
优秀生快乐假期每一天全新寒假作业本系列答案 暑假接力赛新疆青少年出版社系列答案
暑假接力赛新疆青少年出版社系列答案【题目】某化学兴趣小组为测定大理石中碳酸钙的含量,进行如图1所示实验:
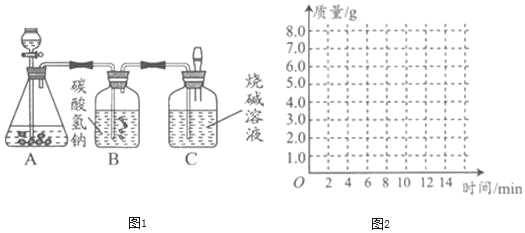
将过量的稀盐酸加入到20 g大理石中(其他成分不与盐酸反应),把产生的CO2气体用足量的烧碱溶液吸收,同时测量C瓶烧碱溶液增加的质量,结果如下表所示:
时间/分 | 0 | 2 | 4 | 6 | 8 | 10 | 12 |
C增加质量/g | 0 | 3.0 | 5.0 | 6.0 | 6.6 | x | 6.6 |
(1)上表中,第10分钟时,x=_____。
(2)计算大理石样品中碳酸钙的质量分数_____。(要写计算过程)
(3)请在如图的坐标纸上,以时间为横坐标,以产生CO2气体的质量为纵坐标,画出能够表明产生气体的质量随时间变化规律的关系曲线_____。
(4)B中所装药品为碳酸氢钠溶液,作用是吸收挥发出的HCl气体,该装置使测量结果_____(填“偏大”“偏小”或“没有影响”)。
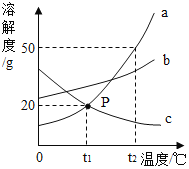
【题目】如表是Na2CO3、NaCl的溶解度。
温度 | Na2CO3 | NaCl |
20℃ | 21.8g | 36.0g |
30℃ | 39.7g | 36.3g |
20℃时,向2只盛有100g水的烧杯中,分别加入30g两种固体,充分溶解。下列说法正确的是( )
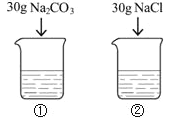
A. 烧杯①中溶质与溶剂的质量比为3:10
B. 烧杯②中溶质的质量分数为30%
C. 烧杯①中溶液升温至30℃,溶质质量分数不变
D. 烧杯①②中溶液升温至30℃(忽略水的蒸发),溶液质量①=②