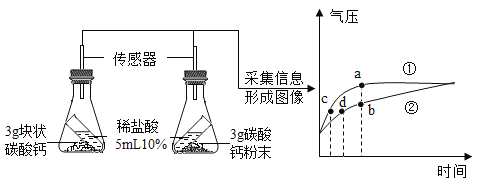
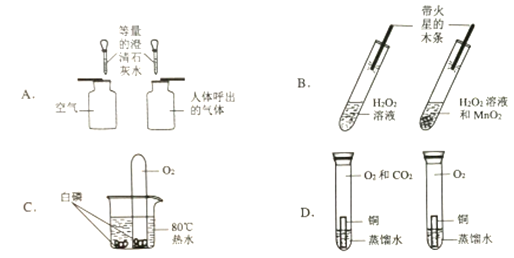
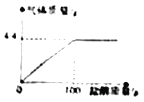
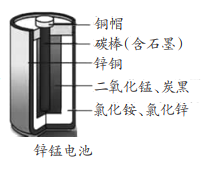
题目内容
【题目】甲、乙、丙、丁和戊五种物质分别属于酸、碱、盐、单质、氧化物中的一种。它们之间的关系如图所示(“→”表示物质间的转化关系,“—”表示两端的物质能发生反应,部分反应物、生成物及反应条件已略去)。甲是由地壳中含量最高的金属元素组成的单质,丁的相对分子量为 135,其水溶液呈蓝色。下列说法中正确的是
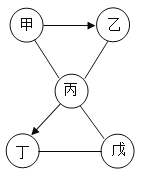
A.甲可能是 Fe,乙可能为 Fe3O4
B.丙→丁的转化可通过中和反应实现
C.甲浸入丁的水溶液中后,表面有银白色固体析出
D.丙与戊的反应可能为 2KOH+ H2SO4 = K2SO4 + 2H2O
【答案】B
【解析】
根据题目给出的流程图和信息:甲是由地壳中含量最高的金属元素组成的单质,因此甲是铝;丁的相对分子量为135,其水溶液呈蓝色,因此丁是氯化铜;又因乙是由甲转化得到的且必须是酸、碱、氧化物中的一类,氧化铝能与盐酸反应,铝与氧气能生成氧化铝,所以乙是氧化铝;因丙是酸、碱中的一类且需要能和金属、金属氧化物反应,且能转化成氯化铜,故丙是HCl,那么戊只能是碱。
A、因为甲是由地壳中含量最高的金属元素组成的单质,所以甲是铝,不可能是Fe,故A错误;
B、由上述分析可知丁是CuCl2,丙是HCl,由丙转化成丁可以是盐酸和氢氧化铜反应生成氯化铜和水,此属于中和反应,故B正确;
C、有上述分析知甲是Al,丁是CuCl2,所以甲浸入丁的水溶液中后,表面有红色固体析出,故C错误;
D、因为丁是CuCl2,所以导致丙只能是HCl,不能是H2SO4,所以丙与戊的反应不可能为2KOH+ H2SO4 = K2SO4 + 2H2O,故D错误。
故选B。

练习册系列答案
 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案
相关题目