题目内容
【题目】某化学兴趣小组做粗盐(含有难溶性杂质)提纯实验,并用所得的精盐配制50g5%的氯化钠溶液。
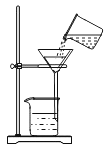
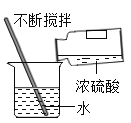
实验一:如图是同学做粗盐提纯实验的操作示意图。回答下列问题:
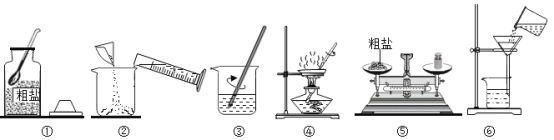
(1)操作③中用玻璃棒搅拌的作用是_____。
(2)操作⑥中的错误是_____。
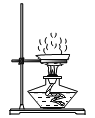
(3)操作④中,当观察到____时,停止加热。
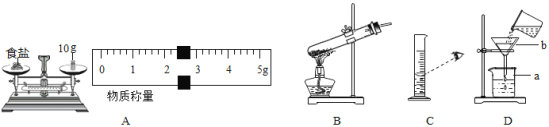
实验二:用提纯得到的精盐配制50g5%的氯化钠溶液,经检测,所配溶液溶质质量分数偏小,其原因可能有____(填序号)。①氯化钠固体仍然不纯 ②称量时砝码与精盐的位置放反 ③量取水时,俯视读数 ④配好装瓶时,有少量溶液洒出
(拓展延伸)为了除去粗盐中CaCl2、MgCl2、Na2SO4等可溶性杂质,需进行如下操作:①溶解;②依次加过量的BaCl2、NaOH、Na2CO3溶液;③过滤;④加适量盐酸;⑤蒸发、结晶。[提示:Mg(OH)2、BaSO4、BaCO3难溶于水;微溶物不形成沉淀;Na2CO3溶液呈碱性]
(1)写出加入BaCl2溶液发生反应的化学方程式____。
(2)写出加入NaOH溶液发生反应的化学方程式:____。
(3)加入过量Na2CO3溶液的目的是____。
【答案】加速粗盐的溶解 没有玻璃棒引流 出现较多固体 ①② Na2SO4+BaCl2=BaSO4 ↓+2NaCl 2NaOH+MgCl2=Mg(OH)2↓+2NaCl 除去氯化钙和过量的氯化钡
【解析】
实验一:(1)操作③是溶解操作,玻璃棒搅拌的作用是加速粗盐的溶解;
(2)操作⑥是过滤操作,过滤液体时,要注意“一贴、二低、三靠”的原则,图中缺少玻璃棒引流;
(3)蒸发时,待蒸发皿中出现较多量的固体时,应停止加热,利用余热将剩余液体蒸干;
实验二:①氯化钠固体仍然不纯,食盐的质量减小,溶质质量分数偏小;
②称量时物品和砝码端放反了,并且使用了游码,食盐的质量减小,溶质质量分数偏小;
③量取水时,俯视读数,量取的水偏少,溶质质量分数偏大;
④装瓶时,有少量溶液洒出,溶质质量分数不变;故选①②;
[拓展延伸](1) 氯化钡和硫酸钠反应生成硫酸钡沉淀和氯化钠,反应的化学方程式为:Na2SO4+BaCl2=BaSO4 ↓+2NaCl;
(2) 氢氧化钠和氯化镁反应生成氢氧化镁沉淀和氯化钠,反应的化学方程式为:2NaOH+MgCl2=Mg(OH)2↓+2NaCl;
(3) 粗盐中CaCl2、MgCl2、Na2SO4等可溶性杂质且加入了过量的氯化钡去除硫酸钠,而碳酸钙、碳酸镁和碳酸钡都是难溶性物质,所以加入过量碳酸钠的作用是除去氯化钙和氯化钡杂质。

【题目】某化学学习小组的同学对一瓶敞口放置的氢氧化钙固体的化学成分产生了兴趣,他们根据自己所学知识进行如下探究:
(提出问题)该瓶药品的化学成分是什么?
(查阅资料)(1)氢氧化钙能与空气中的二氧化碳反应而变质。
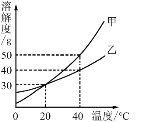
(2)氢氧化钙的溶解度曲线如图。
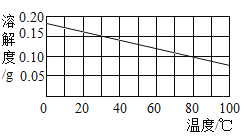
氧化钙溶解度曲线
(猜想假设)猜想一:![]() ; 猜想二
; 猜想二![]() ; 猜想三:_____。
; 猜想三:_____。
(实验验证)
实验操作 | 实验现象 | 实验结论 |
(1)取lg样品放入盛有50g水的烧杯中,充分搅拌后,静置 | 烧杯底部有较多固体未溶解 | 样品中含有 |
(2)取实验(1)中上层清液少许于试管中,再向试管中滴加2~3滴无色酚酞试液 | _____ | 样品中含有 |
(得出结论)甲同学认为猜想三正确。
(反思交流)
(1)乙同学认为甲同学的结论不合理,他认为猜想_____也可能正确,原因是_____。
(2)丙同学认为要想验证猜想三正确,还需做如下实验:取实验(1)中未溶解固体于试管中,向试管中滴加适量稀盐酸,如有_____,则猜想三正确。
(拓展提升)
要想验证反应后物质的成分,除需验证有生成物以外,还应考虑反应物是否_____。