题目内容
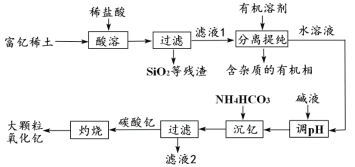
【题目】稀土金属因其独特的性能而被誉为“新材料之母”。稀土金属钇的氧化物(Y2O3)广泛应用于航空航天涂层材料,其颗粒大小决定了产品的质量。利用富钇稀土(含Y2O3约70%,含Fe2O3、CuO、SiO2等约30%)生产大颗粒氧化钇的种工艺如下:
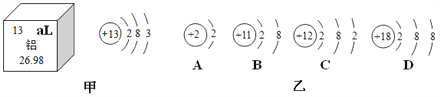
(1)氧化钇(Y2O3)中,Y元素的化合价为____________。
(2)“酸溶”过程中,氧化钇与盐酸反应的化学方程式是______________________________。
(3)“分离提纯”是为了除去滤液1中的_____________________________(填化学式)。
(4)“调pH”时加入碱液使溶液的pH_____________(填“增大”或“减小”)。
(5)碳酸钇灼烧分解的化学方程式是_______________________________________。
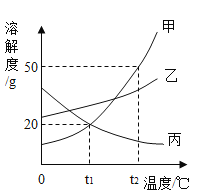
(6)为了获得大颗粒氧化钇,某小组研究了条件对产品直径的影响,相关数据如下(D50表示颗粒直径):
实验编号 | ① | ② | ③ | ④ | ⑤ | ⑥ |
沉淀反应温度/℃ | 60 | 80 | 85 | 93 | 93 | 93 |
料液浓度Kg/L | 30 | 30 | 30 | 30 | 40 | 40 |
灼烧温度/℃ | 1100 | 1100 | 1100 | 1100 | 1100 | 1400 |
氧化钇D50/um | 6.00 | 21.65 | 35.99 | 38.56 | 35.99 | 61.54 |
分析上表数据,其他条件不变时,若将灼烧温度均升高至1400℃,预期所得氧化钇D50最大的是____________(填实验编号)。
【答案】+3 ![]() FeCl3、CuCl2 增大
FeCl3、CuCl2 增大 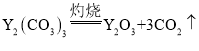 ④
④
【解析】
氧化钇和稀盐酸反应生成氯化钇和水,氧化铁和稀盐酸反应生成氯化铁和水,氧化铜和盐酸反应生成氯化铜和水,碳酸钇灼烧生成氧化钇和二氧化碳。
(1)组成化合物的各元素的化合价代数和为零,设氧化钇(Y2O3)中Y元素的化合价为x,则
![]() ,故Y元素的化合价为+3价。
,故Y元素的化合价为+3价。
(2)“酸溶”过程中,氧化钇与盐酸反应生成氯化钇和水,反应的化学方程式为![]() 。
。
(3) 氧化钇和稀盐酸反应生成氯化钇和水,氧化铁和稀盐酸反应生成氯化铁和水,氧化铜和盐酸反应生成氯化铜和水,“分离提纯”是为了除去滤液1中的FeCl3、CuCl2。
(4)“调pH”时加入碱液使溶液的pH增大。
(5)碳酸钇灼烧分解生成氧化钇和和二氧化碳,反应的化学方程式是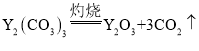 。
。
(6) 由表中数据可知,其他条件不变时,若将灼烧温度均升高至1400℃,氧化钇的生成量最多,故预期所得氧化钇D50最大的是④。

 通城学典默写能手系列答案
通城学典默写能手系列答案【题目】同学们在学习碱的化学性质时,进行了如图所示的实验.

(1)分别写出甲、乙、丙实验中发生反应的化学方程式:
甲_____;乙_____;丙_____.
从微观的角度看,丙反应的实质是_____.
(2)乙实验中滴加氢氧化钠溶液后,可观察到的现象是_____.
(3)丙实验中观察到试管内有白色沉淀产生.
(4)实验结束后,同学们将甲、乙、丙三个实验的废液倒入同一个干净的废液缸中,最终看到废液浑浊并呈红色,产生疑问.
[提出问题]废液中含有哪些物质?
[交流讨论]①一定含有的物质:碳酸钙、指示剂、水和_____(写物质名称).
②还含有能使废液呈碱性的物质.
能使废液呈碱性的物质是什么?同学们有如下猜想.
小云认为:只有碳酸钠
小红认为:只有氢氧化钙
小林认为:是氢氧化钠和碳酸钠
你认为还可能是_____(写一种猜想).
[实验设计]小方想用氯化钙溶液来验证小云、小红、小林的猜想.查阅资料获悉氯化钙溶液呈中性,并设计如下实验.请你将小方的实验设计补充完整.
实验内容 | 预计现象 | 预计结论 |
取少量废液缸中上层清液 于试管中,加入过量 氯化钙溶液,静置. | ①有白色沉淀,溶液呈红色. | _____的猜想正确. |
②_____. | _____的猜想正确. | |
③_____. | _____的猜想正确. |
[反思拓展]在分析化学反应后所得物质的成分时,除了考虑生成物外还需考虑_____.