题目内容
【题目】下表是KNO3和NaNO3在不同温度时的溶解度(单位:g/100g水)。
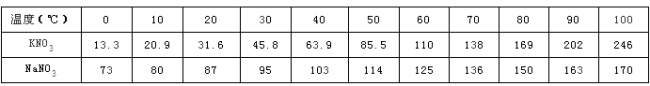
① 10℃时,NaNO3的溶解度是 g/100g水。
② 从表中数据看出KNO3与NaNO3溶解度随温度升高而 (填“增大”或“减小”); 从KNO3饱和溶液中提取KNO3晶体常采用的方法是 。
③ 20℃时,向100g水中加入35gKNO3,要使其完全溶解,应 (填“升高”或“降低”)溶液温度。
④ 现有80℃的NaNO3饱和溶液250g,要使其析出晶体70g应降温至 ℃;
⑤ KNO3和NaNO3在t℃时的溶解度均为W g/100g水,分析上表可推知,W数值所在的最小范围是 ;现将溶剂质量相同的KNO3和NaNO3的饱和溶液从t1℃降温到t2℃,前者析出的晶体比后者多,则t1、t2的取值范围正确的是 (填字母)。
A.仅0≤t2<t1≤t B.仅t≤t2<t1≤100 C.0≤t2<t1≤100 D.0≤t1<t2≤100
【答案】①80 ②增大 降温(冷却)结晶或冷却热饱和溶液 ③升高④10⑤125-136 C
【解析】
试题分析:①由表格可知,10℃时,NaNO3的溶解度为80g;
②从表中数据看出KNO3与NaNO3溶解度随温度升高而增大;硝酸钾的溶解度随温度的变化变化较大,故可采用降温结晶的方法提纯;
③20℃时,硝酸钾的溶解度为31.6g,即向100g水中加入35gKNO3,硝酸钾不能完全溶解,要使硝酸钾完全溶解,则可升温;
④80℃的NaNO3的溶解度为150g,那么80℃的NaNO3饱和溶液250g中溶质的质量为x,150g/250g=x/250g,x=150g,水的质量=100g。要使其析出晶体70g,即溶液中溶质的质量为80g,故要降温至10℃;
⑤由表格信息可知,在60℃至70℃之间存在溶解度相等,即溶解度在125g-136g;由表格信息可知在0≤t2<t1≤100时,溶剂质量相同的KNO3和NaNO3的饱和溶液从t1℃降温到t2℃,前者析出的晶体比后者多。

【题目】某兴趣小组为验证质量守恒定律,做了镁在空气中燃烧的实验。
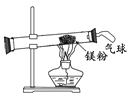
(1)镁与氧气反应的化学方程式为_______________。
(2)根据质量守恒定律小明可知,反应后生成物的总质量应 (填“>”或“=”或“<”)参加反应镁的质量,但实际测量与之不符,小明认为这个反应不遵守质量守恒定律。
(3)小红按右图装置改进实验,验证了质量守恒定律,却发现产物中还有少量黄色固体。
【提出问题】黄色固体是什么?
【查阅资料】①氧化镁为白色固体,氮化镁为黄色固体;
②氧化镁不溶于水,氮化镁能与水剧烈反应产生氨气,氨气能使湿润的红色石蕊试纸变蓝。
【猜想与假设】黄色固体是氮化镁
【进行实验】
实验操作及现象 | 实验结论 |
猜想正确 |
【实验反思】空气中N2的含量远大于O2的含量,而镁在空气中燃烧生成的氧化镁却远多于氮化镁,请给出合理的解释_____________。
(4)小丽继续进行镁与水反应的探究,做了如下实验:
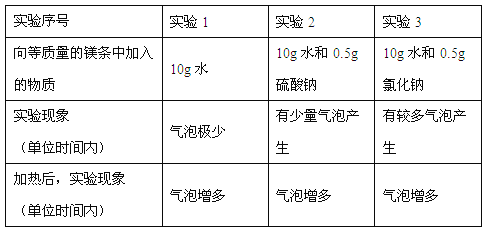
进行实验1的目的是_________________,根据上表中的实验现象,你能得出的结论是______________(写一条即可)。
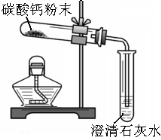
【题目】利用下图装置探究制取气体的原理、方法。

①写出仪器名称:a ,b 。
②用氯酸钾和二氧化锰的混合物制取O2,反应的化学方程式为 ,选用D装置收集氧气,其原因是 ;用二氧化锰和双氧水混合制氧气时, (填“能”或“不能”)用B装置,理由是 。
③实验室常用氯化铵固体与碱石灰固体共热来制取一瓶易溶于水密度比空气小的氨气(NH3),应选择的装置组合是 (填图编号)。

④实验室也可用图B装置制取二氧化碳。相对于C,装置B的优点是 。
若用装置G来收集二氧化碳,气体应该从 端(填“c”或“d”)通入。
⑤某同学欲测定大理石中碳酸钙的质量分数。称取13.5g大理石与50.0g稀盐酸恰好反应(假设杂质不与盐酸反应,忽略盐酸的挥发),数据如下表。
反应时间t/s | t0 | t1 | t2 | t3 | t4 | t5 | t6 |
气体质量m/g | 0 | 0.8 | 1.1 | 2.2 | 4.4 | 4.4 | m |
根据实验数据回答下列问题:
Ⅰ. 当反应时间为t6时,对应的气体质量m为 g;
Ⅱ.反应生成二氧化碳的物质的量为 mol;
Ⅲ.计算大理石中碳酸钙的质量分数是 (通过化学方程式计算,结果精确到0.1%);
Ⅳ.所用盐酸的质量分数 (结果精确到0.1%)。