题目内容
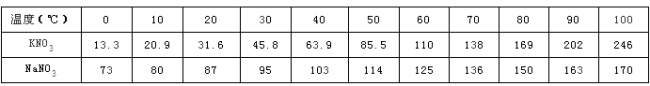
【题目】某化学兴趣小组的同学利用下图实验对碳酸钙高温加热,一段时间,发现石灰水变浑浊,停止加热,同学们对剩余固体的成分进行探究。
【提出问题】加热后剩余固体的成分是什么?
【提出猜想】
猜想一:碳酸钙全部分解,剩余固体成分为 ,
做出该猜想的依据是(用化学方程式表示) 。
猜想二:碳酸钙部分分解,剩余固体成分为 。
【方案与结论】

【答案】【提出猜想】CaO(或氧化钙) CaCO3![]() CaO+CO2↑ CaO和CaCO3
CaO+CO2↑ CaO和CaCO3
【方案与结论】烧杯中液体变红 液体由红色变无色,有气泡产生
【解析】
试题分析:【提出猜想】碳酸钙分解生成的是氧化钙和二氧化碳,若碳酸钙完全分解,那么剩余固体是氧化钙,若部分分解,那么是碳酸钙和氧化钙的混合物;
【方案与结论】氧化钙与水反应生成氢氧化钙,氢氧化钙溶液呈碱性,故若固体中含有氧化钙,那么加水后滴入酚酞,酚酞会变成红色;滴入稀盐酸,若含有碳酸钙,那么稀盐酸与碳酸钙反应生成二氧化碳,产生大量的气泡。由于稀盐酸会与氢氧化钙反应生成氯化钙和水,溶液会呈中性,即酚酞会从红色变成无色。

【题目】除去下列混合物中的杂质,所加试剂及操作方法均正确的是
选项 | 物质(括号内为杂质) | 试剂(过量) | 操作方法 |
A | CO2(CO) | 氢氧化钠溶液和浓硫酸 | 洗气 |
B | KCl(KC1O3) | MnO2 | 加热 |
C | Cu(Fe) | 硫酸铜溶液 | 过滤、洗涤、干燥 |
D | NaCl(Na2CO3) | 氯化钙溶液 | 过滤 |
【题目】同学想研究不同的氧化物能否在氯酸钾制取氧气实验中起催化作用,进行了以下实验:
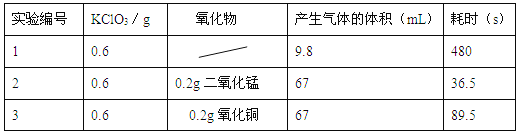
①写出实验2反应的化学方程式 ;
②为证明氧化铜是该反应的催化剂,同学们又完成了以下的实验:
Ⅰ.在实验3反应后的混合物中加足量的水溶解,过滤,将滤渣洗涤并干燥,用电子天平称量,质量为0.2g。
Ⅱ.将过量的CO通入滤出的固体,按右图进行实验:仪器a的名称 。
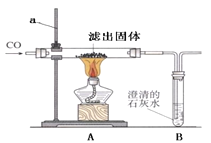
③甲同学的实验报告如下:
装置 | 现象 | 实验结论 |
A | 黑色固体全部变红 | 生成了铜,反应方程式 (7) |
B | 石灰水变浑浊 | 产生了二氧化碳 |
Ⅲ.该实验装置存在的缺陷是
当出现 现象时,证明反应已经开始。
④以上实验证明氧化铜在反应前后质量和化学性质都没改变,能作为氯酸钾受热分解的催化剂。两种氧化物相比, 的催化效果更好。
【题目】除去下列物质中的少量杂质所选用的试剂或方法正确的是()
物质 | 所含杂质 | 除杂所选用试剂或方法 | |
A | CO2 | CO | 点燃 |
B | CaO | CaCO3 | 高温灼烧 |
C | NaOH溶液 | Na2CO3 | 适量稀盐酸 |
D | 稀盐酸 | 稀硫酸 | 适量Ba(NO3)2溶液 |