题目内容
【题目】某化学兴趣小组同学在做铁与硫酸溶液反应的实验时,发现生成的气体有刺激性气味,于是进行了探究。
【提出问题】铁与硫酸溶液反应生成的气体为什么有刺激性气味?
【查阅资料】(1)6H2SO4(浓)+2Fe![]() Fe2(SO4)3+6 H2O +3SO2↑
Fe2(SO4)3+6 H2O +3SO2↑
(2)SO2可使酸性高锰酸钾溶液的紫红色褪去。
【进行猜想】铁与不同浓度的硫酸溶液反应,生成的气体产物中可能有二氧化硫。
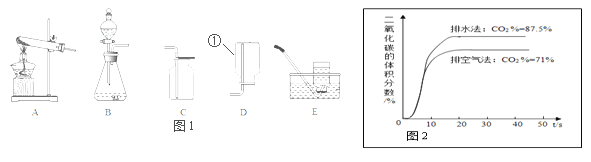
【实验探究】小明用图甲所示的装置进行实验,每次实验A中加入的硫酸溶液体积、铁粉的质量相同。D中收集到的气体进行如图乙所示的爆鸣实验。

请帮助化学兴趣小组同学完成下表:
A中硫 酸浓度 | 实验现象 | A中生成气体成分 | |||
B中酸性高锰酸钾溶液 | C中酸性高锰酸钾溶液 | 爆鸣实验 | |||
实验一 | 98% | __ | 不褪色 | __ | 只有SO2 |
实验二 | 50% | 稍有褪色 | 不褪色 | 有爆鸣声 | __ |
实验三 | 20% | ___ | 不褪色 | 有爆鸣声 | 只有H2 |
【实验结论】铁与不同浓度的硫酸溶液反应,生成的气体产物可能不同,当硫酸浓度达到足够大时,生成的气体产物中有二氧化硫。
【交流反思】写出实验二中发生爆鸣反应的化学方程式:_______。
写出实验三中铁与硫酸反应的化学方程式:_______。
【答案】 褪色 无爆鸣声 有SO2和H2 不褪色 2H2+O2![]() 2H2O H2SO4+ Fe= FeSO4 + H2↑
2H2O H2SO4+ Fe= FeSO4 + H2↑
【解析】【实验探究】实验一:用的是98%的浓硫酸,发生的反应为:6H2SO4(浓)+2Fe![]() Fe2(SO4)3+6 H2O+3SO2↑,SO2可使酸性高锰酸钾溶液的紫红色褪去,没有生成氢气;实验二:B中的现象:稍有褪色,有爆鸣声说明A中生成二氧化硫和氢气;实验三:A中只有H2,则B中酸性高锰酸钾溶液不褪色;【交流反思】实验二中氢气燃烧生成水,反应的化学方程式为:2H2+O2
Fe2(SO4)3+6 H2O+3SO2↑,SO2可使酸性高锰酸钾溶液的紫红色褪去,没有生成氢气;实验二:B中的现象:稍有褪色,有爆鸣声说明A中生成二氧化硫和氢气;实验三:A中只有H2,则B中酸性高锰酸钾溶液不褪色;【交流反思】实验二中氢气燃烧生成水,反应的化学方程式为:2H2+O2![]() 2H2O;实验三中铁与硫酸溶液反应生成硫酸亚铁和氢气,反应的化学方程式为:H2SO4+ Fe= FeSO4 + H2↑。
2H2O;实验三中铁与硫酸溶液反应生成硫酸亚铁和氢气,反应的化学方程式为:H2SO4+ Fe= FeSO4 + H2↑。

 能力评价系列答案
能力评价系列答案 唐印文化课时测评系列答案
唐印文化课时测评系列答案 导学与测试系列答案
导学与测试系列答案【题目】硅钢是制变压器、充电器的核心材料,其主要成分是Fe和Si。某同学用硅钢样品进行如下实验:取6.60 g硅钢样品,将60.00 g稀硫酸分6次加入样品中(其中稀硫酸与硅及其他杂质不反应)。实验测得相关数据如下:
稀硫酸的用量 | 剩余固体的质量 |
第1次加入10.00 g | W g |
第2次加入10.00 g | 4.36 g |
第3次加入10.00 g | 3.24 g |
第4次加入10.00 g | 2.12 g |
第5次加入10.00 g | 1.00 g |
第6次加入10.00 g | 1.00 g |
(1)根据表中数据,稀硫酸加入到第________次,铁恰好反应完全。
(2)表中W=________g。
(3)计算该稀硫酸溶质的质量分数是__________(写出计算过程)。