题目内容
【题目】某化学小组的同学用锌粒与如图1中的硫酸溶液(部分标签被腐蚀)反应时,发现有气泡产生,并闻到有刺激性气味,他们对此气体的成分进行了探究。
【提出问题】锌粒加入硫酸溶液反应生成的气体是什么?
【查阅资料】
①浓硫酸也可以与锌粒发生反应,但不会生成氢气,也不会生成氧气,能生成二氧化硫气体。
②二氧化硫有刺激性气味,易溶于水,能使品红(一种红色素)溶液褪色。
③浓硫酸有吸水性,常用作干燥剂
④氢氧化钠溶液可吸收二氧化硫,并生成亚硫酸钠(Na2SO3)和水
【提出猜想】
甲同学认为:气体可能是H2;
乙同学认为:气体可能是SO2;
丙同学认为:气体还可能是_____。
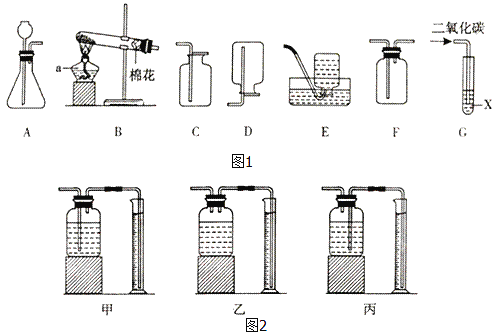
【实验探究】为了验证上述猜想,同学们在老师的指导下设计了如图2的装置(部分夹持器材略去,假设每个能发生的反应都能完全进行)进行探究:

(1)图中a仪器的名称是_____,D处气体发生装置,可选图中的_____(填字母序号)
(2)实验开始后,观察到E中品红溶液褪色,证明气体中含有_____。
(3)H装置的作用是_____,写出发生反应的化学方程式_____。
(4)G装置加热一段时间后,观察到的现象是_____,证明气体中含有氢气。
【实验结论】_____同学的猜想是正确的。
【反思与交流】
(5)锌与浓硫酸反应生成硫酸锌、水和二氧化硫,为何反应过程中又产生氢气了呢?用文字简述原因_____。
(6)锌与浓硫酸、稀硫酸反应都可以生成硫酸锌,如果需要制取硫酸锌,往往选用锌与稀硫酸反应,其优点是_____(答案合理即可)
【答案】 H2和SO2 长颈漏斗 B或C SO2 吸收二氧化硫气体 2NaOH+SO2═Na2SO3+H2O 铜网由黑色变成红色 丙 随着反应进行,浓硫酸变成稀硫酸,稀硫酸和锌反应生成硫酸锌和氢气 更环保。
【解析】气体可能是三种情况;一是氢气单质;二是二氧化硫;三是氢气与二氧化硫的混合物;
(1)a仪器的名称是长颈漏斗;D处的反应物的状态是固体和液体,反应的条件是常温,故可以选装置B或C;
(2)二氧化硫可以使品红溶液褪色,故证明该气体中有二氧化硫气体;
(3)二氧化硫是有毒气体,排放在空中会污染空气,故用氢氧化钠溶液吸收二氧化硫;二氧化硫与氢氧化钠反应生成亚硫酸钠和水,反应方程式为:2NaOH+SO2═Na2SO3+H2O;
(4)气体中含有氢气,故氢气与氧化铜反应,出现的现象是铜网由黑色变为红色;由实验可知,气体是氢气和二氧化硫的混合气体,故丙同学的猜想正确;
(5)锌与浓硫酸反应后有水生成,随着反应进行,浓硫酸变成稀硫酸,稀硫酸和锌反应生成硫酸锌和氢气,故有氢气生成;
(6)锌与浓硫酸反应会生成二氧化硫气体,会污染空气,故用稀硫酸与锌反应的优点是环保;

 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案