题目内容
下列说法正确的是( )
| A、NaOH和MgO的混合物中氧的质量分数为40%,NaOH和MgO的质量比为任意值 |
| B、一定量的氯化钠溶液恒温蒸发5克水,析出a克晶体;再蒸发5克水,又析出b克晶体,a与b一定相等 |
| C、用H2完全还原一定质量的CuO,参加反应的H2与通入的H2质量一定相等 |
| D、将98%的浓H2SO4稀释成49%的稀H2SO4,加入水的质量与浓硫酸质量一定相等 |
考点:元素的质量分数计算,晶体和结晶的概念与现象,用水稀释改变浓度的方法,氢气的化学性质与燃烧实验
专题:化学式的计算,溶液、浊液与溶解度,碳单质与含碳化合物的性质与用途
分析:A.根据物质中元素质量分数的计算方法来分析判断;
B.根据溶液蒸发溶剂析出溶质的量进行分析判断;
C.根据氢气还原氧化铜的注意事项来分析解答;
D.根据溶液稀释过程中溶质的质量不变来分析.
B.根据溶液蒸发溶剂析出溶质的量进行分析判断;
C.根据氢气还原氧化铜的注意事项来分析解答;
D.根据溶液稀释过程中溶质的质量不变来分析.
解答:解:A.分别计算出NaOH 和MgO中氧元素的质量分数:都是40%,所以按任意比混合,氧元素的质量分数都是40%,都是符合要求的,故正确;
B.因为不知道原氯化钠溶液是否饱和,故无法判断前后蒸发5g水后,析出的晶体是否相等,故错误;
C.在做氢气还原氧化铜这一实验时,要先通入一会氢气,目的是排净装置内的空气,以防加热时发生爆炸的危险,故通入的氢气的质量大于参加反应的氢气的质量,故错误;
D.设需要加水的质量为x,浓硫酸的质量为m,则
98%×m=49%×(x+m),则x=m.故加入水的质量与浓硫酸质量相等.故正确.
故选AD.
B.因为不知道原氯化钠溶液是否饱和,故无法判断前后蒸发5g水后,析出的晶体是否相等,故错误;
C.在做氢气还原氧化铜这一实验时,要先通入一会氢气,目的是排净装置内的空气,以防加热时发生爆炸的危险,故通入的氢气的质量大于参加反应的氢气的质量,故错误;
D.设需要加水的质量为x,浓硫酸的质量为m,则
98%×m=49%×(x+m),则x=m.故加入水的质量与浓硫酸质量相等.故正确.
故选AD.
点评:本题考查了物质中元素的质量分数计算方法、不饱和溶液和饱和溶液的蒸发结晶、氢气还原氧化铜的注意事项以及溶液的稀释等知识,难度适中.

练习册系列答案
相关题目
在托盘天平的两边各放一只盛有足量相同质量、相同质量分数稀盐酸的烧杯,调至平衡,然后向左边烧杯中加⒌6g铁,欲使天平再次保持平衡,应向右边烧杯中加入( )
| A、6g镁 | B、⒌6g铜 |
| C、⒌4g氧化钙 | D、10g碳酸钙 |
经过一年的学习,某研究小组对所学化学知识进行归纳,其中有错误的一组是( )
| A、性质与用途:铜具有导电性,可制作导线 |
| B、元素与人体健康的关系:人体缺铁易患贫血症 |
| C、生活常识:电线着火,立即用水浇灭 |
| D、环境保护:为减少水污染,要合理使用农药、化肥 |
类推是学习中常用的思维方法.现有以下类推结果,其中错误的是( )
①酸碱中和反应生成盐和水,所以生成盐和水的反应一定是中和反应;
②氯化钠的水溶液显中性,所以盐溶液一定显中性;
③有氧参加的反应,一定是氧化反应;
④有机物都含碳元素,所以含碳元素的化合物都是有机物.
①酸碱中和反应生成盐和水,所以生成盐和水的反应一定是中和反应;
②氯化钠的水溶液显中性,所以盐溶液一定显中性;
③有氧参加的反应,一定是氧化反应;
④有机物都含碳元素,所以含碳元素的化合物都是有机物.
| A、只有① | B、只有①②③ |
| C、只有①②④ | D、①②③④ |
生活中的下列用品是用热固性塑料做成的是( )
| A、食品包装袋 | B、雨衣 |
| C、塑料插座 | D、蔬菜大棚薄膜 |
有X、Y、Z三种金属,如果把X和Y分别放入稀硫酸中,X溶解并产生氢气,Y不反应;如果把Y和Z分别放入硝酸银溶液中,过一会儿,在Y表面有银析出,而Z没有变化.根据以上实验事实判断,以下金属活动性由强到弱的顺序是( )
| A、Y Ag Z X |
| B、Y X Z Ag |
| C、X Y Ag Z |
| D、X Ag Y Z |
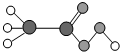 2003年我国部分地区突发“非典”,严重危害人体健康.为防治“非典”,对公共场所进行消毒时常用过氧乙酸消毒液,过氧乙酸的分子结构如图所示:其中
2003年我国部分地区突发“非典”,严重危害人体健康.为防治“非典”,对公共场所进行消毒时常用过氧乙酸消毒液,过氧乙酸的分子结构如图所示:其中 代表碳原子,
代表碳原子, 代表氢原子,
代表氢原子, 代表氧原子.则:过氧乙酸的化学式为
代表氧原子.则:过氧乙酸的化学式为