题目内容
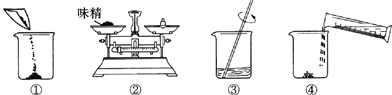
【题目】将质量为44.4克含有少量NaCl 的纯碱晶体(Na2CO3nH2O)样品,平均分成A、B、C三份,进行如图实验(Na2CO3受热不分解)。
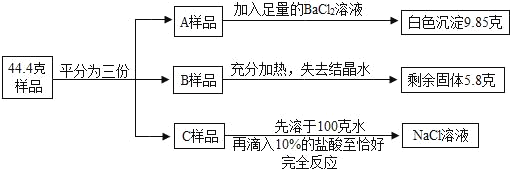
(1)将A样品与BaCl2溶液反应生成的白色沉淀分离出来的方法是_____。
(2)A样品中与BaCl2溶液反应的Na2CO3的质量是_____克。
(3)B样品中含有结晶水的质量是_____克。
(4)化学式Na2CO3nH2O中n是_____
(5)对C样品的操作结束后,所得NaCl溶液的溶质质量分数是多少_____?(精确到0.01%)
【答案】过滤 5.3 9 10 4.26%
【解析】
(1)难溶性固体和液体分离的操作为过滤,故填过滤。
(2)解:设碳酸钠质量为x,反应生成氯化钠质量为y
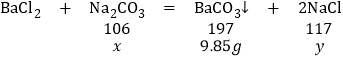
106:197=x:9.85g x=5.3g
197:117=9.85g:y y=5.85g
故填5.3。
(3)B样品中含有结晶水的质量为:(44.4g÷3)﹣5.8g=9g,故填9。
(4)由(2)可知每份样品中碳酸钠的质量为5.3g,根据题意有:106:18n=5.3g:9g,则n=10,故填10。
(5)解:对C样品的操作结束后,所得NaCl溶液中的氯化钠质量为:5.8g﹣5.3g+5.85g=6.35g
设反应生成二氧化碳质量为z
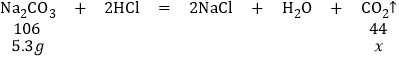
106:44=5.3g:x
z=2.2g,
反应所得溶液质量为:(44.4g÷3)+100g+36.5g﹣2.2g=149.1g,
所得NaCl溶液的溶质质量分数是:![]() ×100%≈4.26%,
×100%≈4.26%,
答:所得NaCl溶液的溶质质量分数是4.26%。

练习册系列答案
 提分百分百检测卷系列答案
提分百分百检测卷系列答案
相关题目