题目内容
【题目】请你参与下列探究:
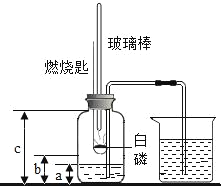
(问题情景)某化学实验小组同学将铁粉投入硫酸铜溶液中,发现生成红色固体物质的同时有较多的气泡放出。这一现象激发起同学们的探究欲望,生成的是什么气体?
(提出猜想)从物质组成元素的角度,放出的气体可能是SO2、O2、H2
(查阅资料)SO2易溶于水,它能与NaOH反应,生成Na2SO3
(方案设计)依据上述猜想,实验小组同学分别设计了如下方案:
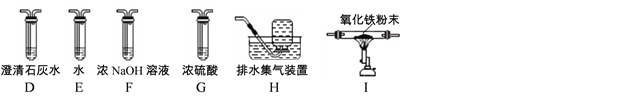
(1)甲同学认为是O2,则可用___________进行检验。
(2)乙同学认为是SO2,则只需将放出的气体通入盛有NaOH溶液的洗气瓶中,称量通气前后洗气瓶的质量。写出SO2与NaOH反应的化学方程式 ____________。
(3)实验小组同学合作设计了如下组合实验方案,排除和验证猜想的气体。如果放出的是O2和H2,你认为方案中的安全隐患是_____________ 。
丙同学认为:为确保安全,实验前应先收集一试管气体,进行_______实验,方可采用下面的装置进行实验。
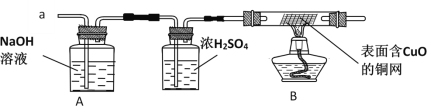
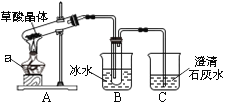
(实验探究)经丙同学确认安全后,小组同学首先对装置A进行称量,再将收集到的气体从a通入,过一会儿点燃B处酒精灯;一段时间后,发现表面含CuO的铜网由黑色变为光亮的红色;停止通气,再次称量装置A,发现质量无增减。
结论:铁粉与硫酸铜溶液反应时,产生的气体是_____________。
(思维拓展)
经检验发现,该硫酸铜溶液中只含有一种阴离子,则由上述实验可以推出,硫酸铜溶液中含有的阳离子是____________。
【答案】用带火星的木条试验,看木条是否复燃 SO2+2NaOH=Na2SO3+H2O 实验时剩余气体通过B中加热的试管易发生爆炸事故 验纯 H2 Cu2+、H+
【解析】
(1)氧气具有助燃性,可使带火星的木条复燃;故填:用带火星的木条试验,看木条是否复燃
(2)二氧化硫是酸性气体,可以与碱氢氧化钠反应生成亚硫酸钠和水,SO2+2NaOH=Na2SO3+H2O;故填:SO2+2NaOH=Na2SO3+H2O
(3)氢气具有可燃性,氢气可以将氧化铜还原为铜,同时生成水,所以黑色铜网变红,有水珠出现;化学方程式为:H2+CuO![]() H2O+Cu;如若不纯,点燃或加热时易产生爆炸事故,所以使用前要注意验纯,一般采用小试管收集点燃的方法,不纯时能发出尖锐的爆鸣声,故填:实验时剩余气体通过B中加热的试管易发生爆炸事故;验纯
H2O+Cu;如若不纯,点燃或加热时易产生爆炸事故,所以使用前要注意验纯,一般采用小试管收集点燃的方法,不纯时能发出尖锐的爆鸣声,故填:实验时剩余气体通过B中加热的试管易发生爆炸事故;验纯
根据:对装置A进行称量,再将收集到的气体从a通入,过一会儿点燃B处酒精灯;一段时间后,发现表面含CuO的铜网由黑色变为光亮的红色,说明有氢气;停止通气,再次称量装置A,发现质量无增减,可知没有SO2,可得出结论为:铁粉与硫酸铜溶液反应时,产生的气体是H2,故填:H2
[思维拓展]
硫酸铜溶液中只含有一种阴离子,是硫酸根离子,由上述实验可以推出,硫酸铜溶液中含有的阳离子是铜离子和氢离子。故填:Cu2+、H+

 名师金手指领衔课时系列答案
名师金手指领衔课时系列答案【题目】化学兴趣小组对“蜡烛及其燃烧”进行探究。
(查阅资料)蜡烛的主要成分是石蜡,石蜡由碳、氢两种元素组成。
问题一:蜡烛燃烧的产物是什么?
问题二:燃着的蜡烛在密闭容器中熄灭的原因是什么?
(作出猜想)问题一:蜡烛燃烧的产物含有二氧化碳和水;除了上述猜想,你的猜想:燃烧产物可能还含有_____。
问题二:熄灭的原因是燃烧消耗完了氧气;熄灭的原因是二氧化碳含量增多。
(实验1)(1)用冷而干的小烧杯罩在蜡烛火焰上,观察到_____,证明有水生成。
(2)用内壁涂有澄清石灰水的小烧杯罩在蜡烛火焰上,观察到_____证明有二氧化碳生成。二氧化碳和石灰水反应的化学方程式为_____。
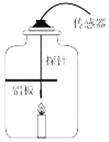
(实验2)在老师的帮助下,在如图所示装置中,点燃蜡烛至熄灭,利用多功能传感器测量了有关量。实验结束后,发现黑色固体颗粒附着在铝板表面,同时传感器获得的实验前后有关数据如表所示:
相对湿度 | 氧气含量 | 二氧化碳含量 | 一氧化碳含量 | |
蜡烛点燃前 | 36.4% | 21.2% | 0.058% | 0 |
蜡烛熄灭后 | 72.6% | 15.6% | 3.843% | 0.0192% |
(实验结论)由实验及结果,蜡烛燃烧生成的产物是_____;密闭容器内蜡烛熄灭的原因是_____。
(反思拓展)含碳燃料不充分燃烧会生成一氧化碳等物质,既浪费资源,又污染空气。为使燃料充分燃烧,应采取的措施是_____(答一条即可)。