题目内容
【题目】归纳是学习的重要方法,小红在复习盐酸的性质时归纳出盐酸的五条化学性质。(如图所示,连线表示相互反应)。
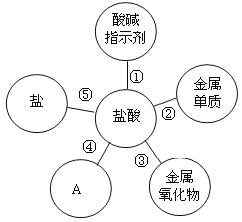
(1)图中A所代表的物质类别是_______________。
(2)为了验证性质③,可选用的物质是___________(填一种即可)。
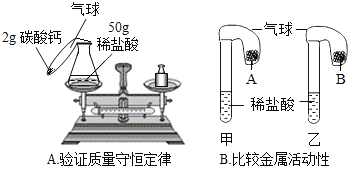
(3)镁和锌可以用来验证盐酸的性质②,小红要探究镁和锌与盐酸反应的快慢,需要控制不变(相同)的量是_______________(填序号)。
A 两种金属的大小
B 盐酸的质量分数
C 反应容器的大小
D 温度
(4)如用湿润的pH试纸测定盐酸的pH,则结果会____________(填“偏大”、“偏小”、“无影响”)。
【答案】碱 氧化铜(合理即可) ABD 偏大
【解析】
(1)酸能与酸碱指示剂、碱、活泼金属、金属氧化物、盐反应,故图中A所代表的物质类别是:碱;
(2)为了验证性质③,可选用的物质是氧化铜,氧化铜能与稀盐酸反应生成氯化铜和水;
(3)控制变量法就是设立相同的外部条件,故要探究镁和锌与盐酸反应的快慢,需要控制不变(相同)的量是:两种金属的大小;盐酸的质量分数;温度等,反应容器的大小对其反应速率无影响。
故选ABD;
(4)如用湿润的pH试纸测定盐酸的pH,会稀释盐酸的浓度,使测得盐酸的pH值偏大。

【题目】酸碱中和反应是初中常见的反应。
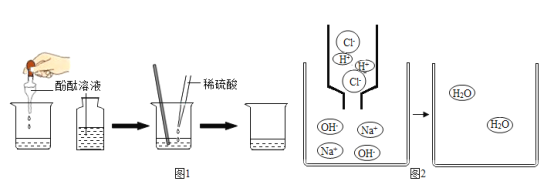
(1)写出上述反应的化学方程式_____;
(2)在氢氧化钠溶液中滴加盐酸,恰好完全反应时其微观示意图如图2,请在图中画出反应后溶液中存在的粒子_____。
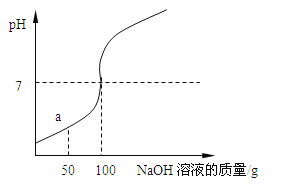
(3)用硫酸代替盐酸也可以进行上述实验,取相同浓度(单位体积内含有酸的分子数相同)的硫酸与盐酸,探究与NaOH溶液发生上述反应所需酸的用量:
实验编号 | 酸的种类 | NaOH溶液的体积 | 反应温度/℃ | 溶液褪色时酸的用量/mL |
① | 硫酸 | 10mL | 25 | 2 |
② | 盐酸 | 10mL | 25 | 4 |
③ | 盐酸 | 10mL | 45 | 5 |
在上述几组实验中,我们同时还需要控制的一个变量是:_____,相同条件下,所需的硫酸溶液更少,原因是相同浓度相同体积时,硫酸溶液含有更多的_____(用化学用语表达),比较②和③发现:其他条件不变,温度升高时,要使溶液褪色需要加入更多的盐酸,原因最可能是_____。
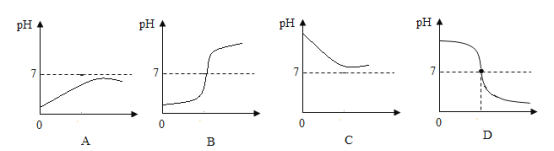
(4)小明同学想调换一下试剂加入的顺序,他先在烧杯中盛10mL稀盐酸,加入几滴酚酞溶液后,用滴管逐滴加入氢氧化钠溶液,并不断搅拌,最终溶液变红,下列曲线能够表示这一过程中溶液pH值变化的是(____)