题目内容
【题目】向盛有一定质量稀硫酸的烧杯中逐渐加入10g锌粒,产生气体质量与锌粒质量的关系如图所示;充分反应后,称得烧杯中剩余物质总质量为109.8g。请根据关系图分析并计算:
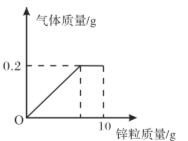
(1)稀硫酸反应完时,产生氢气的质量为 g,消耗锌粒质量为 g。
(2)该稀硫酸中溶质的质量分数(写出计算过程)。
【答案】(1)0.2 6.5 (2)9.8%。
【解析】
试题分析:根据图像可知,产生氢气的质量是0.2 g
解:设产生0.2 g氢气时参加反应的硫酸的质量为x,消耗锌的质量是y
Zn + H2SO4 = ZnSO4 + H2 ↑
65 98 2
y x 0.2g
![]()
![]() =
=![]()
解得 x =9.8g, y=6.5 g
根据质量守恒定律得稀硫酸的质量:109.8g+0.2g-10g=100g
∴稀硫酸中溶质的质量分数=![]() ×100%=9.8%
×100%=9.8%
答:产生氢气的质量是0.2 g,消耗锌的质量是6.5 g,该稀硫酸中溶质的质量分数为9.8%。

练习册系列答案
 培优口算题卡系列答案
培优口算题卡系列答案 开心口算题卡系列答案
开心口算题卡系列答案 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案
相关题目
【题目】根据下表信息,完成表中空格:
化学符号 | 2Fe | ___________ | 3C2H5OH | ___________ |
符号意义 | ___________ | 2个亚铁离子 | ___________ | 高锰酸钾中锰元素的化合价为+7价 |
【题目】20℃时,向3个盛有50克水的烧杯中,分别加入一定质量的氯化钠,并充分溶解。
根据下表实验数据回答。
实验编号 | A | B | C |
加入氯化钠的质量(克) | 9 | 18 | 27 |
溶液质量(克) | 59 | 68 | 68 |
(1)实验所得3杯溶液中,属于不饱和溶液的是 (选填编号)。
(2)若将A杯中的溶液稀释成溶质的质量分数为0.9%的生理盐水,需加水 克。

