题目内容
【题目】用久置的镁条做实验时,需要用砂纸把表面的灰黑色物质磨掉,直到露出光亮的银白色。化学兴趣小组的同学对镁条表面“灰黑色外衣”的成分产生了浓厚兴趣。
(提出问题)镁条表面“灰黑色外衣”的成分是什么?
(作出猜想)
Ⅰ.是镁与空气中的氧气反应生成的氧化镁。
Ⅱ.是镁与空气中的二氧化碳反应生成的黑色碳单质。
Ⅲ.根据铜锈的成分是碱式碳酸铜,推测镁在潮湿的空气中生锈得到的碱式碳酸镁[Mg2(OH)2CO3]。
同学们经讨论,从颜色上否定了只含氧化镁,因为氧化镁是_____
(查阅资料)
①碱式碳酸镁受热可分解,常温下能与稀硫酸反应
②碳不与稀硫酸反应,但与浓硫酸在加热条件下能反应生成CO2、SO2和H2O
(进行实验)
实验一
实验装置 |
|
实验现象与结论 | ①无水硫酸铜粉末逐渐由白色变为蓝色,证明有_____生成②澄清石灰水变浑浊,反应方程式为 |
实验二
实验一试管内物质充分反应并冷却后,向其中加入足量稀硫酸,有气泡产生,但试管底仍有黑色固体。请写出产生气体的化学方程式_____。
实验三
将实验二反应后试管中的混合物进行过滤,弃去滤液,取滤渣加入浓硫酸,加热,固体全部溶解,得澄清溶液并伴有刺激性气味的气体产生。写出化学反应方程式_____。
(得出结论)据上述探究过程,可知久置镁条表面的灰黑色物质含有,不能确定是否含有的物质是_____。
【答案】白色的 水 Mg+H2SO4═MgSO4+H2↑ C+2H2SO4(浓)![]() CO2↑+SO2↑+H2O 久置的镁条是放置在常温下的空气环境中,实验一是将镁粉在加热且有二氧化碳生成的环境中
CO2↑+SO2↑+H2O 久置的镁条是放置在常温下的空气环境中,实验一是将镁粉在加热且有二氧化碳生成的环境中
【解析】
镁与稀硫酸反应生成硫酸镁和氢气, 二氧化碳和澄清石灰水反应生成碳酸钙和水, 碳与浓硫酸在加热条件下能反应并生成CO2、SO2和H2O。
[作出猜想]氧化镁是白色的粉末,所以镁条表面的“灰黑色外衣”不可能只含氧化镁。
[进行实验]
实验一:①无水硫酸铜粉末遇水变成蓝色,证明有水生成。
②二氧化碳和澄清石灰水反应生成碳酸钙和水,反应的化学方程式为:
![]() 。
。
实验二:镁与稀硫酸反应生成硫酸镁和氢气,反应的化学方程式为:![]() 。
。
实验三:碳与浓硫酸在加热条件下能反应并生成CO2、SO2和H2O,反应的化学方程式为: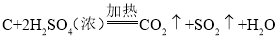 。
。
[得出结论]实验一不足以证明镁条表面“灰黑色外衣”中含有碳,因为久置的镁条是放置在常温下的空气环境中,实验一是将镁粉在加热且有二氧化碳生成的环境中进行的,碳可能是镁和二氧化碳在加热的条件下形成的。

 口算题天天练系列答案
口算题天天练系列答案【题目】某实验小组同学对铁粉和氧化铜的混合物与足量的稀硫酸混合后,体系中各反应的先后顺序进行研究。
氧化铜与稀硫酸反应的化学方程式为________________。
(进行实验)以下实验中所用硫酸都是过量的。
实验1:将铁粉和氧化铜的混合物与60mL、10%稀硫酸混合,实验记录如下。
序号 | 铁粉/g | 氧化铜/g | 实验现象 |
1-1 | 0.56 | 1.6 | 立即出现红色固体,无气泡产生,充分反应后溶液呈蓝色 |
1-2 | 1.12 | 1.6 | 立即出现红色固体,无气泡产生,充分反应后溶液呈浅绿色 |
1-3 | 1.68 | 1.6 | 立即出现红色固体,待红色固体不再增加后产生大量气泡,充分反应后溶液呈浅绿色 |
实验2:将1.12g铁粉和1.6g氧化铜的混合物与30mL不同浓度的硫酸混合,实验记录如下。
序号 | 硫酸浓度/% | 实验现象 |
2-1 | 20 | 立即出现红色固体,无气泡产生,充分反应后溶液呈浅绿色 |
2-2 | 30 | 立即出现红色固体,瞬间产生大量气泡,充分反应后溶液呈浅蓝色 |
2-3 | 50 | 立即出现红色固体,瞬间产生大量气泡,反应过程中生成红色固体的同时持续产生细小气泡,充分反应后溶液呈浅蓝色 |
(解释与结论)
(1)浅绿色溶液中一定含有的溶质是H2SO4、____。
(2)实验中出现红色固体反应的化学方程式为_________;
(3)依据实验1推测,在稀硫酸浓度为10%,且硫酸足量的条件下,铁粉、氧化铜与稀硫酸反应的先后顺序为________。
(4)对比分析实验1-2与1-3,解释实验1-2没有产生气泡的原因______。
(5)在实验1-3中,产生氢气的质量最多为____ g。
6)根据实验2判断,下列说法不正确的是____(填字母序号)。
A 硫酸浓度为20%,CuO先于Fe与硫酸反应
B 硫酸浓度为40%,Fe将先于CuO与硫酸反应
C 硫酸浓度为50%,Fe与CuSO4反应的同时也与硫酸反应
【题目】以菱锌矿(主要成分是ZnCO3,杂质为Fe2O3、FeO、CuO)为原料制备七水硫酸锌(ZnSO47H2O),同时得到铁红副产品,其工艺流程如图,回答下列问题:

(1)“堆浸”前将菱锌矿粉粹成细颗粒,其目的是_____________________;
(2)若实验室用质量分数为98%的硫酸配制200g25%的硫酸,需要98%的硫酸质量为_____g(列出算式即可),需要用到的玻璃仪器有胶头滴管、玻璃棒、烧杯和________,此处玻璃棒的作用是____;
(3)物质X是___________,除铜时发生的反应属于________________反应(填基本反应类型);
(4)“氧化”中加入H2O2的目的是在硫酸的作用下将溶液中的FeSO4转化成Fe2(SO4)3,反应的化学方程式:_______________。
(5)流程中获得七水硫酸锌前省略的操作是______________、冷却结晶、过滤、洗涤和低温烘干;
(6)除铁过程中,反应温度、溶液pH对除铁效果均有影响,为探究除铁的最佳效果,某同学做了以下的实验并记录了相关数据,请回答问题:
编号 | 反应温度/℃ | 溶液pH | 除铁率/% |
a | 30 | 2 | 91.5 |
b | 30 | 2.5 | 93.3 |
c | 40 | 2.5 | 95.1 |
d | 40 | 3.1 | Y |
e | 50 | 3.1 | 99.5 |
①实验____和实验_____对比,得到的结论为其他条件不变时,反应温度增大,除铁率提高;
②实验a和实验b对比,得到结论是____________;
③表中Y的值可能为_____________(填编号)
A 93.4 B 94.1 C 97.8 D 99.6
④最佳的除铁条件为反应温度______℃,溶液pH_________。