题目内容
【题目】金属及其制品是现代生活中常见的材料,请回答下列问题:
(1)人类使用最早的金属材料是_____(填字母)。
A 石器 B 青铜 C 铁器 D 铝制品
(2)铜丝能作为电路导体是因为铜丝具有______性。
(3)下列事实能根据金属的活动性顺序解释的是_____(填字母)。
A 锌能置换出硝酸银溶液中的银
B 等质量的镁、铝分别与足量的酸反应,铝制得的氢气多
C 相同条件下,锌、镁分别与稀硫酸反应,镁比锌剧烈
D 在氯化亚铁中铁元素的化合价为+2价,铜单质中铜元素的化合价为0价
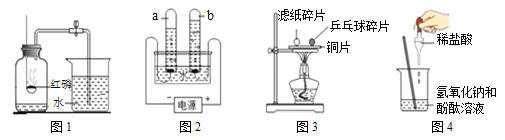
(4)将足量的废弃铝片放入一定量的稀盐酸中,测得生成气体的质量与时间的关系如图所示。由图可知下列结论正确的是_____(填字母)。
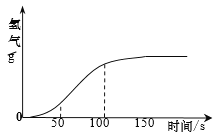
A 反应过程中有热量放出
B 0~50 s时,生成气体不明显,是因为铝表面有一层致密氧化铝薄膜
C 50~100 s时,生成气体的速率急剧加快
D 100 s后生成气体的速率缓慢,说明生成气体快慢与盐酸的浓度有关
(5)现有86 g铝、铁、锌的混合物与稀硫酸恰好完全反应,将所得溶液蒸干得到230 g不含结晶水的硫酸盐固体混合物。则反应产生的氢气质量为_____ g。
(6)金属铝与二氧化锰在高温条件下发生反应,放出大量的热,生成氧化铝和锰单质。试写出该反应的化学方程式______。
【答案】B 导电 AC BCD 3 4Al+3MnO2![]() 2Al2O3+3Mn
2Al2O3+3Mn
【解析】
(1)根据金属活动性顺序,最不活泼的最先使用,所以最早使用的金属是青铜,故选B;
(2)铜丝能作为电路导体是因为铜丝具有导电性,故填:导电;
(3)锌能置换出硝酸银溶液中的银,说明锌比银活泼;
等质量的镁、铝分别与足量的酸反应,铝制得的氢气多,只说明相对原子质量的某些关系;
相同条件下,锌、镁分别与稀硫酸反应,镁比锌剧烈,说明镁比锌活泼;
在氯化亚铁中铁元素的化合价为+2价,铜单质中铜元素的化合价为0价,没有什么可比性。故选AC。
(4)图像所表示的是反应时间与产生氢气的质量关系,与是否产生热量无关;
开始时,因为铝在空气中易在表面形成致密的氧化膜,所以0~50 s时,生成气体不明显,是因为铝表面有一层致密氧化铝薄膜;
当氧化膜反应完后,铝与酸反应时速率很快,所以50~100 s时,生成气体的速率急剧加快;随着反应的进行,盐酸的浓度在不断减小,反应逐渐减慢,所以100 s后生成气体的速率缓慢,说明生成气体快慢与盐酸的浓度有关。故选BCD。
(5)由题意知,生成物中硫酸根离子的质量为:230g-86g。
设生成的氢气的质量为x。
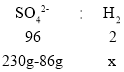
![]()
x=3g,故填:3。
(6)金属铝与二氧化锰在高温条件下发生反应,放出大量的热,生成氧化铝和锰单质。该反应的化学方程式:4Al+3MnO2![]() 2Al2O3+3Mn。
2Al2O3+3Mn。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】用久置的镁条做实验时,需要用砂纸把表面的灰黑色物质磨掉,直到露出光亮的银白色。化学兴趣小组的同学对镁条表面“灰黑色外衣”的成分产生了浓厚兴趣。
(提出问题)镁条表面“灰黑色外衣”的成分是什么?
(作出猜想)
Ⅰ.是镁与空气中的氧气反应生成的氧化镁。
Ⅱ.是镁与空气中的二氧化碳反应生成的黑色碳单质。
Ⅲ.根据铜锈的成分是碱式碳酸铜,推测镁在潮湿的空气中生锈得到的碱式碳酸镁[Mg2(OH)2CO3]。
同学们经讨论,从颜色上否定了只含氧化镁,因为氧化镁是_____
(查阅资料)
①碱式碳酸镁受热可分解,常温下能与稀硫酸反应
②碳不与稀硫酸反应,但与浓硫酸在加热条件下能反应生成CO2、SO2和H2O
(进行实验)
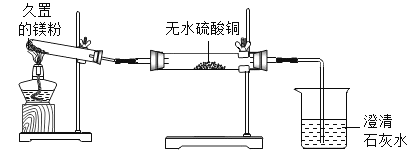
实验一
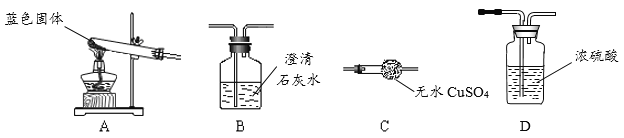
实验装置 |
|
实验现象与结论 | ①无水硫酸铜粉末逐渐由白色变为蓝色,证明有_____生成②澄清石灰水变浑浊,反应方程式为 |
实验二
实验一试管内物质充分反应并冷却后,向其中加入足量稀硫酸,有气泡产生,但试管底仍有黑色固体。请写出产生气体的化学方程式_____。
实验三
将实验二反应后试管中的混合物进行过滤,弃去滤液,取滤渣加入浓硫酸,加热,固体全部溶解,得澄清溶液并伴有刺激性气味的气体产生。写出化学反应方程式_____。
(得出结论)据上述探究过程,可知久置镁条表面的灰黑色物质含有,不能确定是否含有的物质是_____。
【题目】某实验小组用石墨做电极进行电解水实验,为增加导电性,改用氢氧化钙饱和溶液进行电解,实验时除两个电极均有气泡冒出外,在正极石墨电极的附近溶液中还出现了白色浑浊,该小组对白色浑浊出现的原因进行了如下探究。
[资料]
Ⅰ.氢氧化钙的溶解度曲线如图所示。

Ⅱ.氢氧化钙饱和溶液通电后温度约上升5℃。
[猜想]
①电解过程中溶液温度升高导致Ca(OH)2析出而出现白色浑浊。
②电解过程中水减少导致Ca(OH)2析出而出现白色浑浊。
③与石墨电极(主要成分是碳)有关。
[实验]
实验 | 实验装置 | 主要实验操作 | 实验现象 |
1 | 取10mL Ca(OH)2饱和溶液,稍加热,溶液温度上升5℃ | 溶液中未出现白色浑浊 | |
2 |
| 用石墨做电极,取Ca(OH)2饱和溶液于水槽中,通电2分钟 | a、b试管中都有气泡产生;a试管中溶液未出现白色浑浊;b试管中溶液明显出现白色浑浊 |
3 | 更换石墨电极为铜电极,取Ca(OH)2饱和溶液于水槽中,通电2分钟 | a、b试管中都有气泡产生;与电源正极相连的铜电极变墨,a、b试管中溶液未出现白色浑浊 |
(1)Ca(OH)2的溶液度随温度升高而__________(填“减少”或“增大”);实验1中当液温度上升5℃后得到的溶液为Ca(OH)2 __________(填“饱和”或“不饱和”)溶液。
(2)实验1得出的结论是___________________________________________________________。
(3)实验2,取b试管中白色浑浊溶液,加10mL水,振荡,发现试管中白色浑浊不溶解,据此证明猜想_______(填序号)不合理。
(4)实验3中更换石墨电极为铜电极的目的是__________________________________________;与电源正极相连的铜电极变黑的原因是_____________________________________________(用化学方程式表示);为除去铜电极上的黑色物质,需要的试剂是_____________(写一种即可)。
(5)通过探究过程,用石墨做电极进行实验时,正极石墨电极附近Ca(OH)2溶液出现白色浑浊的原因是__________________________________________________________________________。