题目内容
【题目】海洋中蕴含丰富的资源。
(1)海水淡化是解决淡水资源不足的重要方法。下列方法中,可以使海水变为淡水的是_____(填字母序号)。
A 滤纸过滤 B 吸附 C 沉降 D 蒸馏
(2)从海水中制备纯碱和金属镁的流程如图所示:
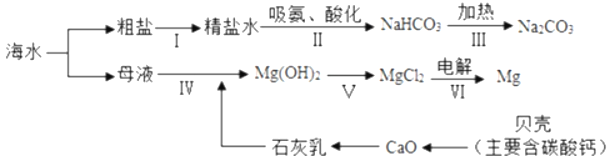
回答下列问题:
①步骤Ⅴ中所加试剂是_____。
②第Ⅲ步反应的化学方程式是_____。
③在海边用贝壳作原料制生石灰,比用石灰石作原料的优点是_____(写一条)。
【答案】D 稀盐酸 2NaHCO3![]() Na2CO3+CO2↑+H2O 减少贝壳污染(或提高经济效益、减少资源浪费等其他合理答案也可)
Na2CO3+CO2↑+H2O 减少贝壳污染(或提高经济效益、减少资源浪费等其他合理答案也可)
【解析】
(1)A、过滤是除去不溶性杂质的方法,不能除去水中的可溶性物质,故错误;B、吸附是除去水中色素、异味等不溶性杂质的一种方法,不能除去水中的氯化钠、氯化镁等可溶性盐,故错误;C、沉降是使大颗粒不溶物快速沉淀下来,不能除去水中的可溶性物质,故错误;
D、蒸馏是通过加热的方法将水变成水蒸气,再冷凝成水的方法,可以得到最纯的蒸馏水,可将水淡化,故正确。故选:D;
(2)①氢氧化镁为白色沉淀,与盐酸反应生成氯化镁;故填:稀盐酸;②碳酸氢钠在加热的条件下分解为碳酸钠、水和二氧化碳;故填:2NaHCO3![]() Na2CO3+CO2↑+H2O;
Na2CO3+CO2↑+H2O;
③在海边用贝壳作原料制生石灰,比用石灰石作原料的优点既可减少贝壳污染又可提高经济效益;故填:减少贝壳污染(或提高经济效益、减少资源浪费等其他合理答案也可)。

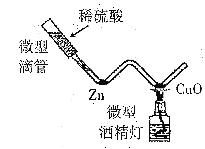
【题目】为测定某金属锌样品中锌单质的质量分数,称取该样品进行如图所示实验.多次实验后,所得数据(平均值)如下表:
反应前质量 | 充分反应后质量 | |
装置+稀硫酸(足量) | 锌样品 | 装置+剩余物质 |
342.10g | 16.00g | 357.70g |
实验中发生反应:Zn+H2SO4=ZnSO4+H2↑.若锌样品中杂质不参加反应,且不考虑容器中水分蒸发.
求:
(1)生成氢气的质量为_____g
(2)该锌样品中锌单质的质量分数________(要求写出计算过程)