题目内容
【题目】化学是以实验为基础的学科。
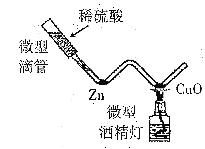
(1)用“W”型管进行微型实验,如图所示。
①锌粒处的现象是_______________;
②CuO处发生反应的化学方程式是_______________________;(答出一条即可)。
③微型实验的优点是___________
(2)为了除去粗盐中CaCl2、MgCl2、Na2SO4等可溶性杂质,需进行如下操作:①溶解;②依次加过量的BaCl2、NaOH、Na2CO3溶液;③过滤;④加适量盐酸;⑤蒸发、结晶。(提示:微溶物不形成沉淀)
①加入过量碳酸钠的作用是什么___________?
②加入适量盐酸的作用是什么___________?
③过滤后,得到的沉淀共有哪些___________?
④以上操作中所发生的复分解反应共有几个___________?
(3)100g稀盐酸和5g碳酸钙粉末恰好完全反应,求稀盐酸中溶质的质量分数___________。
【答案】固体表面有气泡生成 CuO+H2 ![]() Cu+H2O 节约药品 除去氯化钙和过量的氯化钡 除去过量的碳酸钠和氢氧化钠 硫酸钡、氢氧化镁以及碳酸钡和碳酸钙 6个 3.65%
Cu+H2O 节约药品 除去氯化钙和过量的氯化钡 除去过量的碳酸钠和氢氧化钠 硫酸钡、氢氧化镁以及碳酸钡和碳酸钙 6个 3.65%
【解析】
氯化钡和硫酸钠反应生成硫酸钡沉淀和氯化钠,加入了过量的氯化钡去除硫酸钠;氢氧化钠和氯化镁反应生成氢氧化镁沉淀和氯化钠,加入了过量的氢氧化钠可除去氯化镁;碳酸钠和氯化钙反应生成碳酸钙沉淀和氯化钠,碳酸钠和氯化钡反应生成碳酸钡沉淀和氯化钠,加入了过量的碳酸钠可除去氯化钙和过量的氯化钡;氢氧化钠和稀盐酸反应生成氯化钠和水,碳酸钠和稀盐酸反应生成氯化钠、水和二氧化碳,加适量盐酸可除去过量的氢氧化钠和氯化钠。
(1)①锌粒与硫酸反应生成硫酸锌和氢气,所以对应的现象是 固体表面有气泡生成;
②CuO处发生反应是氧化铜和氢气在加热的条件下生成铜和水,对应的化学方程式是 CuO+H2![]() Cu+H2O;
Cu+H2O;
③微型实验的优点是节约药品。
(2)根据分析可知:
①加入过量碳酸钠的作用是除去氯化钙和过量的氯化钡;
②由于加入的碳酸钠和氢氧化钠过量,所以加入适量盐酸的作用是除去过量的碳酸钠和氢氧化钠;
③过滤后,得到的沉淀共有硫酸钡、氢氧化镁以及碳酸钡和碳酸钙;
④以上操作中所发生的复分解反应为Na2SO4+BaCl2=BaSO4↓+2NaCl;MgCl2+2NaOH=2NaCl+Mg(OH)2↓;CaCl2+Na2CO3=CaCO3↓+2NaCl;Na2CO3+BaCl2═BaCO3↓+2NaCl;NaOH+HCl=NaCl+H2O;Na2CO3+2HCl═2NaCl+H2O+CO2↑.共有6个;
(3)设:稀盐酸中溶质的质量分数为x。
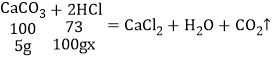
![]() x=3.65%。
x=3.65%。
答:稀盐酸中溶质的质量分数为3.65%。