题目内容
【题目】向含CuCl2和HCl的100 g混合溶液中,逐滴加入溶质质量分数为10%的NaOH溶液,参加反应的NaOH溶液质量与生成沉淀质量关系如图,仅考虑沉淀为Cu(OH)2。则下列说法正确的是 ( )
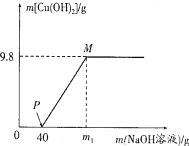
A. 整个反应过程中,溶液中氯离子个数不变
B. PM段的溶液中加入铁粉,会产生气泡
C. M点溶液中氯化钠的质量分数为8.3%
D. 沉淀完全时,m1的数值为80
【答案】AC
【解析】化学反应过程只是原子重新组合的过程,反应前后原子的种类、个数不变。向含CuCl2和HCl的100 g混合溶液中,逐滴加入溶质质量分数为10%的NaOH溶液,氢氧化钠和氯化铜反应生成氢氧化铜和氯化钠,盐酸和氢氧化钠反应生成氯化钠和水。A.因为只生成氢氧化铜沉淀,故A选项整个反应过程中,氯离子个数都存在于溶液中,所以溶液中氯离子个数不变;B.向混合物中加入氢氧化钠时,盐酸先和氢氧化钠反应,所以P点溶液中的溶质有两种氯化钠和氯化铜,PM段的溶液中加入铁粉,发生的反应是铁和氯化铜生成铜和氯化亚铁,所以不会产生气泡;C. 设氢氧化钠和盐酸反应生成氯化钠的质量为x
HCl + NaOH==H2O+NaCl
40 58.5
40g×10% x
40/ 40g×10%=58.5/x x=5.85g
设氢氧化钠和氯化铜反应生成氯化钠的质量为y
CuCl2+2NaOH==Cu(OH)2↓+2NaCl及有关数据可知是正确的叙述;
80 98 117
z 9.8g y
98/9.8g=117/y y=11.7g
98/9.8g=80/z z=8g 和氯化铜反应的氢氧化钠溶液的质量为:8g÷10%=80g
M点氯化钠的质量为11.7g+5.85g=17.55g
M点溶液的质量为40g+80g+100g-9.8g=210.2g
M点溶液中氯化钠的质量分数为17.55g÷210.2g ×100%≈8.3%,
D. 沉淀完全时,m1的数值为80g+40g=120g
选AC

【题目】下图的锥形瓶内是空气,试管中盛有部分水,现向试管中加入某种物质后,会使U形管内b处的液面高于a处的液面。则该物质不可能是………( )
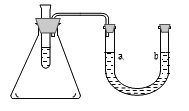
A. 氯化钠 B. 浓硫酸 C. 生石灰 D. 氢氧化钠固体
【题目】测定空气中氧气含量的实验:


(1)实验中,气球的作用是___________;反应的原理为_____________(用化学方程式表示);该反应的基本反应类型是_______;装置一比装置二更合理,理由是:_________
(2)根据下表提供的实验数据,完成下表:
硬质玻璃管中空气的体积 | 反应前注射器中空气体积 | 反应后注射器中气体体积 | 实验测得空气中氧气的体积分数 |
30mL | 20mL | 12mL | ________________ |
【题目】为探究氢氧化钙溶液和稀盐酸反应所得溶液中溶质的成分,小鸣和同学们通过测定了反应后溶液的pH,得到了如下图所示的pH曲线,请回答:
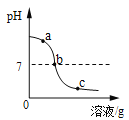
(1)由图可知该实验操作是将__________滴加到另一种溶液中;
(2)该反应的化学方程式为___________;
(3)实验过程中,小鸣取了a、b、c三处反应后的溶液于三个烧杯中,却忘了作标记,请你设计不同的方案(不再用测定pH的方法),探究三种样品分别属于哪处溶液。
【查阅资料】CaCl2溶液显中性,CaCl2+Na2CO3=CaCO3↓+2NaCl。
【探究过程】
①分别取少量样品于三支试管中,加入酚酞试液,观察到其中一支试管内出现___________的现象。结论:该样品是a处溶液。
②为进一步确定b或c处溶液,又设计了以下方案:
实验步骤 | 实验现象 | 实验结论 |
另取余下样品少量于两支试管中,分别滴加足量的Na2CO3溶液。 | ________ | 该样品为b处溶液。 |
【反思评价】探究反应后溶液中溶质的成分,除了要考虑生成物之外,还要考虑____________。
【题目】铜片在潮湿的空气中久置,表面会产生绿色的铜锈。某小组同学设计并进行
实验,探究铜生锈的条件。
![]()
【猜想与假设】常温下,铜生锈可能与O2、CO2、水蒸气有关。
【进行实验】通过控制与铜片接触的物质,利用右图装置(铜片长
8cm,宽1cm,试管容积为20mL),分别进行下列7个实验,并持续观察30天。
编号 | 主要实验操作 | 实验现象 |
1 | 充满纯净的O2 | 铜片均无明显变化 |
2 | 充满纯净的CO2 | |
3 | 充满经煮沸并迅速冷却的蒸馏水 | |
4 | 加入蒸馏水5mL(液面未浸没铜片),再充满O2 | |
5 | 加入经煮沸并迅速冷却的蒸馏水5 mL,再充满CO2 | |
6 | 充入10mL O2,再充入10mLCO2 | |
7 | 加入蒸馏水5ml,再依次充入10mL CO2和10mL O2 | 铜片生锈,且水面附近锈蚀最严重 |
【解释与结论】
(1)实验3中,要使用经煮沸并迅速冷却的蒸馏水,原因是_______。
(2)实验5的目的是_______。
(3)通过上述实验,得出铜生锈的条件是_______。
【反思与评价】
(4)请写出一种防止铜制品锈蚀的方法_______。
(5)查阅资料可知,铜锈的主要成分是碱式碳酸铜,化学式为Cu2(OH)2CO3。由此,你认为上述实验中只需进行实验(填实验编号),就可探究出铜生锈条件,理由是_______。
(6)与以上进行的实验对比,你认为铜片在通常状况的空气中,生锈非常缓慢的原因
可能是_______。




