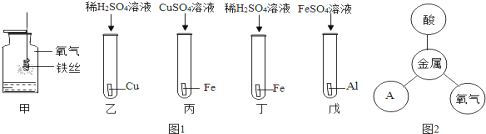
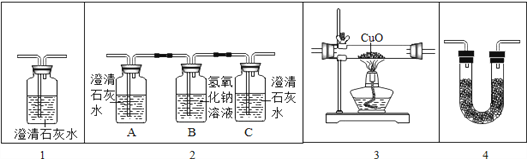
题目内容
【题目】测定空气中氧气含量的实验:
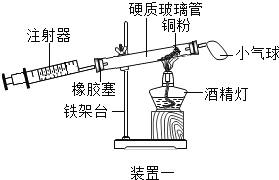

(1)实验中,气球的作用是___________;反应的原理为_____________(用化学方程式表示);该反应的基本反应类型是_______;装置一比装置二更合理,理由是:_________
(2)根据下表提供的实验数据,完成下表:
硬质玻璃管中空气的体积 | 反应前注射器中空气体积 | 反应后注射器中气体体积 | 实验测得空气中氧气的体积分数 |
30mL | 20mL | 12mL | ________________ |
【答案】 缓冲作用 2Cu+O2△2CuO 化合反应 装置一中的氧气反应更充分 16%
【解析】(1)测定空气中氧气含量的原理是,利用物质与空气中的氧气反应,又不生成气体,使容器内气体减少,压强变小,容器内减少气体体积就等于瓶内氧气的体积。气球的作用是调节气压,使氧气完全反应,使测定结果更准确;该实验中利用的是铜和氧气反应生成固体氧化铜,反应为2Cu+O2 △2CuO;由两种或两种以上物质生成一种物质的反应叫化合反应;与装置二相比较,装置一更合理,理由是:气体流通更流畅,氧气消耗更彻底;(2)由题中信息可知,反应前装置内空气共50mL,反应后共48mL,所以氧气为8ml,实验测得空气中氧气的体积分数8ml÷50mL×100%=16%。

练习册系列答案
相关题目