题目内容
【题目】锌是人体必需的的微量元素,称“生命元素”。
【锌的广泛应用】
(1)处于生长发育期的儿童、青少年如果缺锌,会导致发育不良,食欲差,反应迟钝。缺乏严重时,将会导致“_________ 症”和智力发育不良。 补“锌”采用药补与食补并举,经常吃贝壳类海产品、红色肉类等含锌的食物有利补“锌”,这个“锌 ”指_____。
A. 单质 B. 元素 C. 原子 D. 分子
(2)实验室用锌与稀硫酸制取氢气,同时得到副产品硫酸锌。反应的化学方程式为___________________。
【制备七水硫酸锌】
以含锌废渣(主要成分为ZnO,杂质为FeO﹑CuO)为原料制备七水硫酸锌(ZnSO4·7H2O)的流程如下。

(1)粉碎的目的是___________________。
(2)若实验室用质量分数为98%,密度为1.84g/ml的浓硫酸配制200g、25%的稀硫酸,需要浓硫酸的体积为___________(精确到小数点后一位),配制时,需要的玻璃仪器有量筒﹑玻璃棒、烧杯和__________,
(3)物质X是__________,滤渣中含有的金属单质有__________,
(4)流程中获得七水硫酸锌前省略的操作是_______﹑冷却结晶﹑过滤、洗涤和低温烘干。
(5)某温度下,Fe(OH)3分解得到一种铁﹑氧质量比21:8的氧化物,该氧化物的化学式__________。
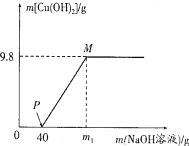
(6)除铁过程中,温度、pH对除铁效果的影响分别对如图所示。由图可知,除铁时温度应控制在__________℃为宜,pH应控制在__________为宜。

【组成测定】在一定条件下,向ZnSO4溶液中加入Na2CO3溶液,充分反应后,经过滤、洗涤、低温干燥得到纯净滤渣aZnCO3·bZn(OH)2·cH2O。为了确定aZnCO3·bZn(OH)2·cH2O组成,进行如下实验:

【查阅资料】(假设每步反应、吸收均完全。碱石灰为氢氧化钠和生石灰的混合物。)
aZnCO3·bZn(OH)2·cH2O受热分解生成ZnO、H2O、CO2三种产物,
其中ZnCO3 ![]() ZnO+CO2↑;Zn(OH)2
ZnO+CO2↑;Zn(OH)2![]() ZnO+H2O。
ZnO+H2O。
现称取35.9 g aZnCO3·bZn(OH)2·cH2O在B装置中进行煅烧,将完全煅烧过程中产生的气体依次通过装置C和装置D,它们分别增重7.2 g和4.4 g。
【实验分析及数据处理】
(1)装置A的作用是_______________。
(2)若没有E装置,测得二氧化碳的质量____________(填“偏大”、“偏小”或“无影响”)。
(3)根据上述数据,化学式a ZnCO3·b Zn(OH)2· c H2O中的a:b:c =_____________ 。
【反思与拓展】
滤渣成分因温度等不同导致a、b、c会有差异,假设B化学式为ZnCO3·2Zn(OH)2·H2O,向该B中加入稀硫酸,反应的化学方程式为:_____________。
【答案】 侏儒 B Zn+H2SO4==ZnSO4+H2↑ 增大接触面积,使反应更快更充分 22.7ml 胶头滴管 Zn Zn、Cu 蒸发浓缩 Fe3O4 83±1 3.5±0.1 除去空气中的CO2 和H2O 偏大 1∶2∶2 ZnCO3·2Zn(OH)2·H2O + 3H2SO4 = 3ZnSO4 + 6H2O + CO2↑
【解析】【锌的广泛应用】(1)处于生长发育期的儿童、青少年如果缺锌,会导致发育不良,食欲差,反应迟钝。 缺乏严重时,将会导致“侏儒症”和智力发育不良。贝壳类海产品、红色肉类等含锌的食物有利补“锌”,这个“锌 ”指元素。(2)锌与稀硫酸,生成硫酸锌和氢气。反应的化学方程式为Zn+H2SO4==ZnSO4+H2↑,【制备七水硫酸锌】(1)粉碎的目的是增大接触面积,使反应更快更充分;98%,密度为1.84g/ml的浓硫酸配制200g、25%的稀硫酸,需要浓硫酸的体积为x,则x×1.84g/ml×98%=200g×25%; x≈22.7ml; 需要的玻璃仪器有量筒﹑玻璃棒、烧杯和胶头滴管;(3)除铁后的溶液中含有硫酸铜和硫酸锌,要除掉铜,得硫酸锌溶液,所以加入的金属X是锌,滤渣中的金属有反应生成的铜和过量的锌。(4)要通过降温结晶得到七水硫酸锌,则应该先将溶液加热浓缩,然后再降温结晶;(5)设铁的氧化物的化学式为FexOy;56x/16y=21:8, x/y=3/4,所以氧化物为Fe3O4;除铁过程中,温度、pH对除铁效果的影响分别对如图所示。(4)由图可知,除铁时温度应控制在83±1 _℃为宜,pH应控制在3.5±0.1_为宜;【实验分析及数据处理】(1)装置A中碱石灰是氢氧化钠和氧化钙的混合物,能吸收水和二氧化碳,装置A的作用是除去空气中的CO2 和H2O 。(2)若没有E装置,D中的碱石灰能吸收空气中的水和二氧化碳,使测得二氧化碳的质量偏大;(3)装置C增加的量为水的质量,和装置D增加的为二氧化碳的质量,所以反应生成7.2 g水和4.4 g二氧化碳。aZnCO3·bZn(OH)2·cH2O受热分解生成ZnO、H2O、CO2,,据质量守恒定律可知反应前后物质的总质量不变,可知生成氧化锌的总质量为35.9g-7.2g-4.4g=24.3g;设碳酸锌分解生成氧化锌的质量为xZnCO3 ![]() ZnO+CO2↑;
ZnO+CO2↑;
81 44
X 4.4g
81/x=44/4.4g x=8.1g
则有氢氧化锌分解生成氧化锌的质量为24.3g-8.2g=16.2g
设氢氧化锌分解生成水的质量为y
Zn(OH)2![]() ZnO+H2O。
ZnO+H2O。
81 18
16.2g y
81/16.2g=18/y y=3.6g
所以35.9g aZnCO3·bZn(OH)2·cH2O中结晶水的质量为7.2g-3.6g=3.6g, 化学式a ZnCO3·b Zn(OH)2· c H2O中的a:b:c =1:2:2

【题目】同学们运用对比的学习方法探究碱的性质。
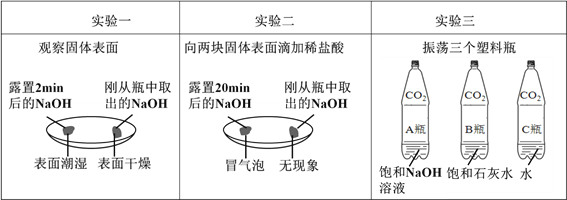
①由上图实验一、二可知,氢氧化钠会吸收空气的______________,因此要密封保存。
②实验三中可观察到三个软塑料瓶变瘪的程度大小为A>B>C, A瓶内发生反应的化学方程式为_____________________,对比A瓶与____________(选填“B”或“C”)瓶的实验现象可证明CO2 能与NaOH发生反应。
③同学们设计如下两种方案鉴别氢氧化钠溶液与饱和氢氧化钙溶液(编号为A、B)。
方案一 | 方案二 | 分析 |
| 微热(不考虑水分蒸发) | 两种方案中均观察到A试管内出现白色浑浊,A中试剂为____________; 方案二的设计原理是利用了_____________。 |
【题目】鸡蛋主要由蛋壳、蛋壳膜、蛋白、蛋黄等几个部分组成,其中蛋壳的主要成分是CaCO3,里面覆盖一层蛋壳膜。我校兴趣小组的同学为此开展了以下探究活动:

【提出问题1】
(1)鸡蛋白中含有的营养成分是_________________。
【查阅资料】
a.蛋壳是经过自然形成。科学手段检测蛋壳中含CaCO3约82%—85%,蛋白质15%—17%,并含多种微量元素;
b.蛋壳膜中蛋白质约占90%—93%。
【提出问题2】
蛋壳中的CaCO3含量是多少呢?小华拟将该蛋壳放在空气中充分灼烧完成测定;小明拟通过蛋壳与稀盐酸反应完成测定。请你参与他们的探究。
【设计方案】他们分别称取12.0 g蛋壳设计了以下不同的实验方案:
(2)小华的方案:
称取12.0 g蛋壳研磨成粉末置于通风橱中,灼烧至质量不再减少,再称量剩余固体的质量为7.16g。则:产生的CO2质量__________g,蛋壳中的CaCO3的质量分数为________%(结果保留到小数点后一位)。
(3)小明的方案:小明设计了如下图所示的实验装置。(已知其他成分均不与稀盐酸反应,装置内试剂均足量)
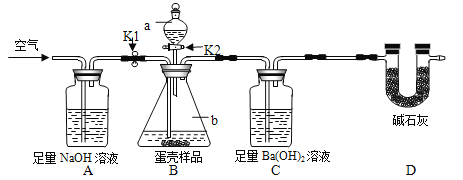
【实验步骤】
① 出编号仪器的名称:a___________,b__________;
② 按上图连接好装置后,并________________;
③ 向B装置中加入蛋壳样品后,先通入空气一会儿;
④ __________K1,_________K2(填“打开”或“关闭”),向蛋壳样品中滴入10%的盐酸,直到B中___________________为止(填实验现象);
⑤ 再通入一会儿空气,目的是___________________;
⑥ 将装置C中的固液混合物过滤、洗涤、干燥后称量其质量;
⑦ 重复上述实验。
【实验数据】重复实验,3次数据记录如下:
实验次数 | 实验1 | 实验2 | 实验3 |
装置C中沉淀质量(g) | 19.68 | 19.75 | 19.67 |
【实验分析及数据处理】
① 上述数据能否用托盘天平称量_______________。(填“能”或“不能”)
② 若无A装置,直接通入空气,则测定结果将___________。(填“偏大”、“偏小”或“不变”)
③ 实验重复3次的目的是____________________。
④ 请利用3次实验数据的平均值,计算该蛋壳中的CaCO3含量____________(已知:BaCO3相对分子量为197,结果保留到小数点后一位)。(请写出具体的计算过程,该空2分)
【实验反思】
(1)下列各项措施中,能提高小明测定准确度的是____________________(填字母序号)。
A.在装置A、B之间增加盛有浓硫酸的洗气瓶
B.缓缓滴加稀盐酸
C.在装置B、C之间增加盛有饱和NaHCO3的洗气瓶
(2)大家讨论后,一致认为小明的方案更合理,你认为小华方案存在较大误差的原因主要是______________。