题目内容
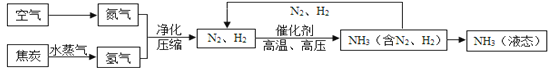
【题目】(6分)氢化钙固体是登山运动员常用的能源提供剂。探究小组在烧杯中放入10g氢化钙样品,再加入到20g水充分搅拌,完全反应后测得烧杯内物质的总质量为29.2g。(已知氢化钙(CaH2)与水反应的化学方程式为:CaH2 + 2H2O ![]() Ca(OH)2 +2 H2↑)
Ca(OH)2 +2 H2↑)
请计算:
(1)生成氢气的质量。
(2)样品中氢化钙的质量分数。
【答案】(1) 0.8g;(2)84%
【解析】
试题分析:(1)根据质量守恒定律计算氢气质量;(10g+20g)-29.2g=0.8g。(2)利用化学方程式进行计算。
解:设样品中氢化钙的质量为x
CaH2 + 2H2O ![]() Ca(OH)2 +2H2↑
Ca(OH)2 +2H2↑
42 4
x 0.8g
![]()
x=8.4g
样品中氢化钙的质量分数为:![]()
答:(1) 生成氢气的质量为:0.8g;
(2) 样品中氢化钙的质量分数位84%

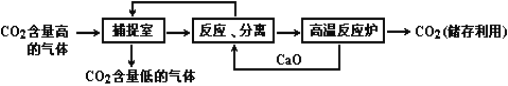
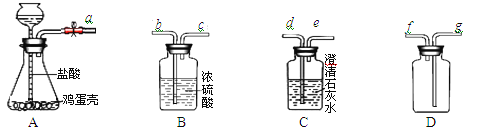
【题目】(9分)现有下列装置,回答问题:
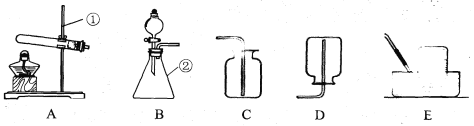
(1)写出有标号仪器的名称:① ,② ;
(2)实验室用双氧水和二氧化锰制取氧气的化学方程式为 ,发生装置为 (填字母序号)。若反应过于剧烈,从实验安全角度考虑,可以采取的措施有 (写一种即可);
(3)实验室用高锰酸钾制取氧气,为进一步研究高锰酸钾的分解产物,某兴趣小组查阅资料,并取一定质量的高锰酸钾加热使之完全分解,进行下表所示的实验。
【实验内容】:
编号 | 实验内容 | 实验现象 | 实验结论 |
1 | 取反应后固体剩余物0.2g 加入5mL6%的 | 剧烈反应,放热 产生大量气泡 | 生成物中的 催化分解 |
2 | 取0.2g ( | 平稳反应,放热,持续产生气泡 |
分解 |
3 | 取反应后固体剩余物1.0g,加入足量水,充分溶解,过滤 | 固体完全溶解,滤纸 上无黑色固体残余物 | 固体剩余物中无 |
【实验分析】:
①完善上表中的填空内容:实验2 、实验3 ;
②实验2的目的是 ;
③经讨论,实验1的结论不正确,理由是 ;
【资料】:在43.9℃~377.9℃范围中,![]() span>受热分解时,会发生以下两个反应:
span>受热分解时,会发生以下两个反应:
![]()
④取8.0g![]() ,加热使之完全分解,生成
,加热使之完全分解,生成![]() 的质量可能为 (填字母序号);
的质量可能为 (填字母序号);
A.0.81g B.1.08g C.1.42g D.1.62g
⑤资料显示,![]() 在43.9℃一377.9℃范围中的失重率(
在43.9℃一377.9℃范围中的失重率(![]() 与
与![]() 的质量比)为18.0%。结合资料分析,在43.9℃~377.9℃范围中,
的质量比)为18.0%。结合资料分析,在43.9℃~377.9℃范围中,![]() 分解反应主要以 (填“a”或“b”)为主。
分解反应主要以 (填“a”或“b”)为主。