题目内容
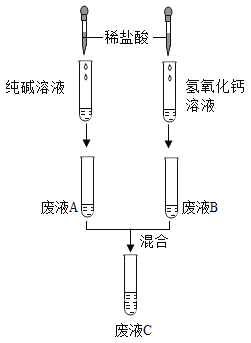
【题目】实验小组研究盐酸、氢氧化钙两种物质的化学性质,做了如下图所示8个实验。
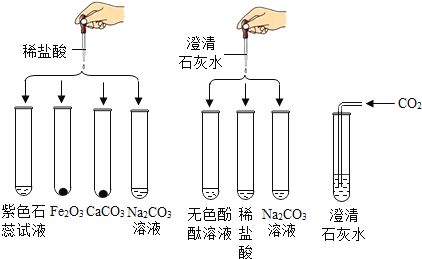
已知:Na2CO3 + CaCl2CaCO3↓ + 2NaCl
(1)实验后某试管中为黄色溶液,该试管中发生反应的化学方程式为________。
(2)实验后某试管中为红色溶液,向其中加入足量的________,溶液变为无色。由此推断,该试管中最初盛有的物质是________。
(3)实验后某试管的底部有白色固体,过滤后向滤液中滴加稀盐酸,一段时间后有气泡出现。由此推断,该试管中最初发生反应的化学方程式为________。
(4)实验后某试管中只得到无色溶液,向其中加入足量的Na2CO3溶液,无明显现象。由此推断,该试管中最初发生反应的化学方程式为________,原无色溶液中的溶质是(写出所有可能)________。
【答案】Fe2O3+6HCl=2FeCl3+3H2O 稀盐酸或稀硫酸 无色酚酞溶液 Na2CO3+Ca(OH)2=CaCO3↓+2NaOH Na2CO3+ 2HCl=2NaCl+H2O+CO2↑ Na2CO3、NaCl或只有NaCl
【解析】
(1)8支试管中只有盛放Fe2O3的试管中滴入稀盐酸后试管中为黄色溶液,Fe2O3和稀盐酸反应生成氯化铁和水,反应的化学方程式为:Fe2O3+6HCl=2FeCl3+3H2O。
(2)8支试管中反应后变为红色溶液的有2支,石蕊溶液中滴入稀盐酸,无色酚酞溶液中滴入澄清石灰水,但石蕊溶液变红后无论加入什么都不会变成无色,酚酞溶液加入可溶性碱后变红,如果加入酸将碱性物质反应完,溶液就会变为无色。因此符合此现象的是原来试管中是无色酚酞溶液,加入澄清石灰水后变红,然后加入稀盐酸或稀硫酸后红色会变为无色。
(3)由图可知只有澄清石灰水与Na2CO3溶液的反应、CO2与澄清石灰水的反应有白色沉淀生成,过滤后向滤液中加稀盐酸,一段时间后有气泡出现,如果是CO2与澄清石灰水的反应,过滤后滤液中只有水或者是含有少量氢氧化钙的溶液,加入稀盐酸没有气泡产生,因此最初只能是澄清石灰水与Na2CO3反应,且碳酸钠有剩余,最初发生的化学反应是:Na2CO3+Ca(OH)2=CaCO3↓+2NaOH。
(4)8支试管中最初只得到无色溶液的只有2支,碳酸钠溶液加入稀盐酸、稀盐酸中加入澄清石灰水,稀盐酸中加入澄清石灰水生成氯化钙,而题中向其中加入足量的Na2CO3溶液,无明显现象,说明其中不含氯化钙。由此可知该试管中最初是Na2CO3溶液,加入稀盐酸发生的反应是:Na2CO3+2HCl=2NaCl+H2O+CO2↑;反应后的溶液为无色,溶质可能是只有NaCl或NaCl和Na2CO3(因向其中加入Na2CO3溶液无现象,所以不可能有HCl)。