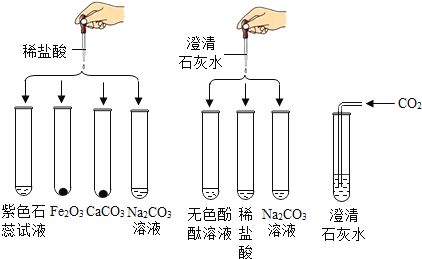
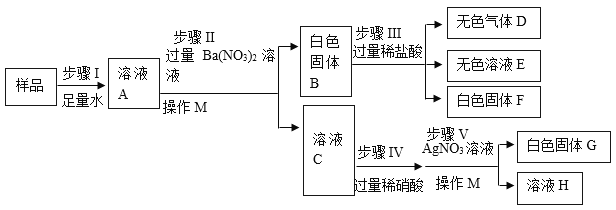
题目内容
【题目】甲、乙、丙三种固体(均不含结晶水)的溶解度曲线如图所示,请回答。
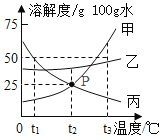
①t1℃时,固体丙的溶解度是___g/100g水。
②甲溶液中含有少量乙,得到甲晶体的方法是____。
③t2℃时,甲物质的饱和溶液中,溶质与溶剂的质量比为____, 能将该饱和溶液转化为不饱和溶液的一种方法是___。
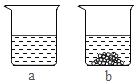
④t2℃时,取甲、乙两种固体各6g分别加入20g水中充分溶解,实验现象如图所示,则烧杯a中溶解的物质是___(填“甲”或“乙”)。
⑤根据溶解度曲线,说法正确的是_____。
I 将甲物质的溶液由t3℃降温到t2℃,一定有晶体析出
II t3℃,三种物质的饱和溶液分别恒温蒸发等质量的水,析出晶体质量:甲>乙>丙
III将甲物质的饱和溶液由t2℃升温至t3℃时,其溶质质量分数增大
IV t3℃,三种物质的饱和溶液分别降温至t2℃,所得溶液的溶质质量分数:乙>甲=丙
【答案】50 降温结晶 1:4 (或25:100) 加水(或升温) 乙 II
【解析】
①由图可知t1℃时,固体丙的溶解度是50g/100g水;
②甲溶液中含有少量乙,由于甲的溶解度受温度影响较大,且随温度升高而增大,乙的溶解度受温度影响较小,得到甲晶体的方法是降温结晶;
③t2℃时,甲的溶解度为25g/100g水,甲的饱和溶液中,溶质与溶剂的质量比为25:100,即1:4, 甲的溶解度受温度影响较大,且随温度升高而增大,能将该饱和溶液转化为不饱和溶液的一种方法是升温或加水;
④t2℃时,甲的溶解度比乙的小,取甲、乙两种固体各6g分别加入20g水中充分溶解,实验中,a中完全溶解,b中固体有剩余,则烧杯a中溶解的物质是乙;
⑤I、将甲物质的饱和溶液由t3℃降温到t2℃,一定有晶体析出,甲的不饱和溶液降温时不一定析出晶体,选项错误;
II、t3℃,三种物质的溶解度由大到小的顺序是:甲>乙>丙,三种物质的饱和溶液分别恒温蒸发等质量的水,析出晶体质量:甲>乙>丙,选项正确;
III、将甲物质的饱和溶液由t2℃升温至t3℃时,其溶质不析出,溶质、溶剂的质量都不变,溶质质量分数不变,选项错误;
IV、 t3℃时,将甲、乙、丙三种物质的饱和溶液降温到t2℃,甲、乙的溶解度减小,析出晶体,得t2℃的饱和溶液。![]() ,但是t2℃时,乙的溶解度比甲的大,所得溶液溶质的质量分数:乙>甲,降温时,丙的溶解度变大,溶质不析出,溶液中溶质的质量分数不变,等于t3℃时饱和溶液溶质的质量分数,丙在t3℃时的溶解度比甲在t2℃时的溶解度小,所得溶液中溶质质量分数甲>丙,降温到t2℃三种物质所得溶液溶质的质量分数大小关系是乙>甲>丙,选项错误。故选II。
,但是t2℃时,乙的溶解度比甲的大,所得溶液溶质的质量分数:乙>甲,降温时,丙的溶解度变大,溶质不析出,溶液中溶质的质量分数不变,等于t3℃时饱和溶液溶质的质量分数,丙在t3℃时的溶解度比甲在t2℃时的溶解度小,所得溶液中溶质质量分数甲>丙,降温到t2℃三种物质所得溶液溶质的质量分数大小关系是乙>甲>丙,选项错误。故选II。

【题目】“84”消毒液具有漂白、杀菌、消毒的功效。在新冠肺炎预防措施中使用较为广泛。某化学兴趣小组对一瓶敞口久置的“84”消毒液的成分产生兴趣,在老师的指导下,展开探究。
(査阅资料)“84”消毒液的主要成分是次氯酸钠(NaClO)和氯化钠。NaClO为有效成分,且有腐蚀性并易与空气中的CO2反应(2NaC1O+CO2+H2O=2HC1O+Na2CO3)。NaClO溶液、HC1O都具有漂白、杀菌、消毒功效。HC1O不稳定,受热或光照条件下会发生分解生成氯化氢和氧气。
(分析讨论)小组同学经过讨论,认为该消毒液中的溶质一定有______,可能还有NaClO、Na2CO3、HClO中的一种或多种。
(实验探究)
实验操作 | 实验现象 | 实验结论 |
I.向装入有色布条的试管中加入适量该消毒液 | 有色布条长时间不褪色 | 消毒液中不含的溶质____ |
П.另取少量该消毒液于试管中,滴入足量氯化钡溶液,静置 | 产生白色沉淀 | 消毒液中含有的溶质___ |
(交流反思)
(1)生活中“84”消毒液贮藏时应注意_____。一般不用“84”消毒液对蔬菜、水果进行消毒,其原因可能是_____。
(2)“84”消毒液与洁厕灵(主要成分是盐酸)混合使用易产生一种有毒气体,反应的化学方程式为NaClO+2HC1=NaCl+X↑+H2O,则X的化学式为______。